
7.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH===CH3COO- +H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
6.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(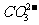 )、c(
)、c(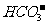 )都减少,其方法是
)都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通人氯化氢气体 D.加入饱和石灰水
5.下列物质的溶液呈碱性的是
A.Na2CO3 B.Na2SO4
C .NH4NO3 D.CH3COOH
4.下列有关化学反应速率的说法中正确的是
A.100mL 2mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
3.下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
2.下列说法不正确的是
A.在化学反应过程中放出或吸收的热量称为反应热
B.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
C.在25℃、l01kPa时,1mol物质完全燃烧生成稳定的化合物时,所放出的热量叫做该物质的燃烧热
D.在稀溶液中,1mol酸跟1moll碱发生中和反应所放出的热量叫做中和热
1.下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.所有自发进行的化学反应都是熵增的过程
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有过程
D.同一物质的固、液、气三种状态的熵值相同
21.(6分)现有一份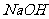 固体样品,里面混有少量的
固体样品,里面混有少量的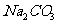 ,
,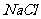 杂质,某同学用中和滴定的方法来测定
杂质,某同学用中和滴定的方法来测定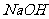 的纯度。其操作如下:
的纯度。其操作如下:
①称取ag样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的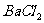 溶液,使
溶液,使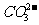 沉淀完全。
沉淀完全。
③向所得混合液中滴入2-3滴酚酞指示剂,然后用cmol/L的盐酸进行滴定。
④当反应到达终点时,测得消耗盐酸的体积为vmL。
⑤计算样品的纯度。
试回答下面的问题:
(1)滴定终点时溶液颜色如何变化?__________________________________
(2)第②步中生成的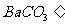 未过滤出来就直接用盐酸滴定,是否会对
未过滤出来就直接用盐酸滴定,是否会对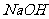 的含量测定造成影响(填“是”或“否”)______理由是_______________________
的含量测定造成影响(填“是”或“否”)______理由是_______________________
(3)能否改用甲基橙作指示剂_______________
(4)根据上述实验数据,列出计算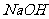 纯度的表达式________________
纯度的表达式________________
20.(9分)(1)苯与浓硝酸、浓硫酸的混合酸共热可发生取代反应。实验操作的设计需考虑到反应物的性质,回答下列问题:
①配制浓硝酸、浓硫酸的混合酸的操作是________________________________
②考虑到苯的沸点为80.1℃,据此分析,加热的温度应____________,据此温度,加热的方式应选择___________;实验中常在装反应混合物的试管上配一带有长玻璃导管的单孔塞。作用是_______________________________________________________________
③考虑到苯的溶解特性,向混酸中滴加苯时,同时还要进行的操作是_____________
④写出反应的化学方程式________________________________________________
(2)物质的检验、鉴别要特别注意到共存物质的干扰,否则得到的结论就是不可靠的,例如,实验室用乙醇、浓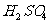 在170℃时制得的
在170℃时制得的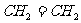 中混有
中混有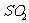 ,用溴水或酸性
,用溴水或酸性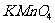 溶液检验生成的
溶液检验生成的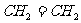 时,就要考虑到
时,就要考虑到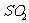 的影响,因为
的影响,因为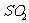 也能使溴水或酸性
也能使溴水或酸性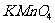 溶液褪色,所以检验有
溶液褪色,所以检验有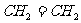 生成就需先除去
生成就需先除去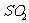 。下列实验设计所得结论可靠的是_______________________________________________________________
。下列实验设计所得结论可靠的是_______________________________________________________________
A.将电石与水反应产生的气体通人酸性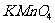 溶液中,溶液褪色说明有乙炔生成。
溶液中,溶液褪色说明有乙炔生成。
B.将溴乙烷与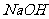 的乙醇溶液共热产生的气体通入到酸性
的乙醇溶液共热产生的气体通入到酸性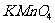 溶液中,溶液褪色说明有
溶液中,溶液褪色说明有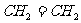 生成
生成
C.将溴乙烷与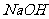 的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成
的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成
D.将苯、液溴、铁粉混合物反应产生的气体通人到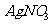 溶液中有淡黄色沉淀产生,说明有
溶液中有淡黄色沉淀产生,说明有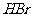 生成。
生成。
19.(12分)用于制造塑料薄膜、人造革、塑料管材和板材的聚氯乙烯(PVC塑料)可由电石、水、氯化氢为主要原料通过三步反应来制备:
(1)写出上述制备过程中第三步反应的化学方程式:_______________________
(2)由上述第一步反应可制得乙炔,乙炔通入溴水中可使溴水褪色,写出乙炔与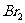 发生第一步反应所得产物的一种结构式,并命名____________________________
发生第一步反应所得产物的一种结构式,并命名____________________________
(3)PVC塑料也可由乙烯和氯气等为主要原料通过加成、______和______ (填反应类型)三步主要反应来生产,其中,第二步反应的化学方程式为__________________
(4)通常PVC塑料有毒,不能用作食品包装材料,食品包装材料可用聚乙烯塑料来制作。据二者的组成差异,鉴别两种塑料的简便方法是__________________________
(5)废弃的塑料制品有害于环境,被称做“白色污染”,因为它们在大自然中降解非常慢,有人估计废弃的农用薄膜在土壤中可长达l00年不分解,这将严重影响土壤的通透性,危害作物的生长。下列对废弃PVC塑料的处理正确的是
A.集中回收掩埋 B.回收进行再加工,制成新的塑料
C.集中焚烧处理 D.加热裂解,用以制备新的化工原料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com