
26.(4分)AgCl的Ksp=1.80 ×10-10,将0.001mol/L NaCl和0.001mol/L AgNO3溶液等体积混合,试通过计算判断是否有AgCl沉淀生成?
25.(8分)将等物质的量的A、B混合于2L的密闭容器中发生反应3A(g)+B(g) xC,经5min后,测得D的浓度为0.5mol/L,
xC,经5min后,测得D的浓度为0.5mol/L,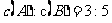 ,C的平均反应速率是0.1mol/(L·min)。则:
,C的平均反应速率是0.1mol/(L·min)。则:
(1)此时,A的物质的量浓度为 ;
(2)反应开始前容器中A、B的物质的量为 ;
(3)B的平均反应速率为 ;
(4)x的值为 。
24.(8分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2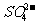
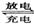 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变 ;当外电路通过1mol电子时,理论上负极板的质量增加 g。
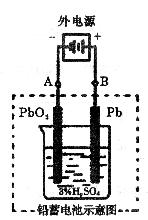
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A极上成 ,此时铅蓄电池的正负极的极性将 。
23.(6分)(1)常温下,将0.2mol/L HCl溶液与0.2mol/L MOH等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
(2)常温下,若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”或“一”)
(3)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得溶液的pH≠7,则混合溶液的pH 。(填“>7”、“<7”或“不能确定”)
22.(7分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫做活化能,其单位通常用kJ/mol表示,请认真观察右图,然后回答下列问题:
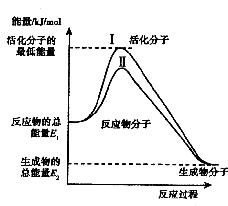
(1)图中表示的反应是 填“吸热”或“放热”)反应,该反应
(填“需要”或“不需要”)加热,该反应的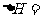 (用含
(用含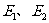 的代数式表示)。
的代数式表示)。
(2)已知热化学方程式: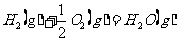
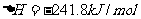 。该反应的活化能为l67.2kJ/mol,则其逆反应的活化能为
。
。该反应的活化能为l67.2kJ/mol,则其逆反应的活化能为
。
(3)对于同一反应,图中曲线Ⅱ与曲线I相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。
21.(5分)在一定体积的密闭容器中,进行如下化学反应: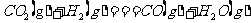 ,其化学平衡常数K和温度t的关系如下表:
,其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c) 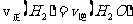 (d)
(d) 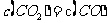
(4)某温度下,平衡浓度符合下式: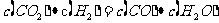 ,试判断此时的温度为 ℃。
,试判断此时的温度为 ℃。
(4)你同意哪种观点? ,理由是 。(用化学原理说明,如上述两种观点都不同意,请说明理由) 。
20.(9分)在课堂上,老师提出“电解CuCl2溶液的过程中pH如何变化”的问题,让同学们展开探究式的讨论。一部分同学依据理论认为:电解CuCl2溶液一段时间后,溶液的pH会升高;另一部分同学持怀疑态度,课后做实验得出如下数据:
|
时间/min |
0 |
10 |
20 |
30 |
60 |
|
pH |
4 |
3 |
2 |
1 |
l |
请回答下列问题:
(1)电解前溶液pH=4的原因是(用离子方程式说明) 。
(2)部分同学认为pH会升高的依据是 。
19.(8分)如图,水槽中试管内有一枚铁钉,放置数天观察。请回答下列问题:
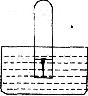
(1)若试管内液面上升,则原溶液呈现 性,发生 腐蚀,电极反应:正极: 。
(2)若试管内液面下降,则原溶液呈现 性,发生 腐蚀,电极反应;负极: 。
18.已知反应mX(g)+nY(g) qZ(g)
qZ(g) 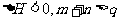 ,在恒容密闭容器中反应达到平衡时,下列说法正确的是
,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.x的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率增大,X的转化率降低
第Ⅱ卷(非选择题 共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com