
4.下列有关说法中,正确的是 ( )
A.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
B.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
C.三种氢化物的沸点高低:HBr>HCl>HF
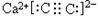 D.CaC2的电子式为
D.CaC2的电子式为
3.有关热化学方程式书写与对应表述均正确的是 ( )
A.稀醋酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
|
热量。则Fe(s)+S(s)==FeS(s) ;△H=-95.6KJ/mol
C.氢气的燃烧热为285.5 KJ/mol,则水电解的热化学方程式:
 2H2O(l) 2H2(g)+O2(g);△H=+285.5 KJ/mol
2H2O(l) 2H2(g)+O2(g);△H=+285.5 KJ/mol
D.已知2C(s)+O2(g)=CO(g) ;△H=-221 KJ/mol,则可知C的燃烧热为110.5 KJ/mol
2.能保存在带磨口玻璃塞的无色试剂瓶中的物质是 ( )
A.氟化钠溶液 B.浓硝酸 C.氯化铝溶液 D.碳酸钠溶液
1.2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔是因为他在表面化学所作的开创性研究,他的方法不仅被用于学术研究而且被用于化学工业研发。下面选项与物质的表面特性无关的是 ( )
A.合成氨用铁粉做催化剂
B.用明矾来净水
C.用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
D.配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
31.某污水处理厂用化学和生物方法处理污水,若污水中所含糖类(CH2O)n有45%被完全
氧化,即发生(CH2O)n+nO2→nCO2+nH2O;另有10%经过发酵过程进行无氧分解,即
2(CH2O)n→nCO2+nCH4。其余部分糖类仍然留在沉积物中,当该厂每天CO2和CH4共16.0m3(标准状况)时,求:
(1)每天被氧化和被发酵的糖类共多少千克?
(2)每天有多少千克糖类留在沉积物中?
|
(4)生成的CH4可用来生产水煤气:CH4+H2O CO+3H2,该厂每天能生产多少立方米水煤气(标准状况)?
30.目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和
氢氧化铝组成。现按如下步骤测定药剂中三种主要成分的配比:
(1)取药剂样品,研磨后,加入50mL3.6mol·L-1盐酸,正好完全反应并收集得到标准状况下224mL气体
(2)过滤,弃去其中不溶性物质(其余成分不参与反应)
(3)取(2)中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
试求该药剂中三种主要成分的物质的量之比。
29.克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
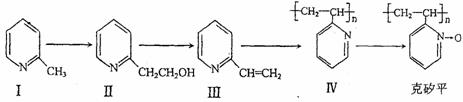
(1)化合物Ⅰ的某生质类似苯。例如,化合物Ⅰ可以在一定条件下与氢中所发生加成反
应生成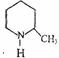 ,其反应方程式为
(不要求标出反应条件)
,其反应方程式为
(不要求标出反应条件)
(2)化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是 (填字母)
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅱ不可以与金属钠反应生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 (不要求标出反应条件)
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 。
28.近日,油炸薯条再次出现食品安全危机,因为其中反式脂肪酸(trans fatty acids 简称
TFA)的含量增加了1/3。中国食疗网发布“反式脂肪酸预警报告”,报告称:摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。顺式脂肪酸、反式脂肪酸的结构如图所示。
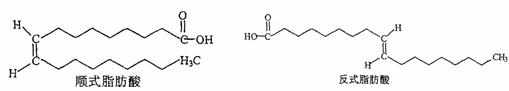
试回答下列问题:
(1)顺(反)式脂肪酸中所含官能团名称是 。
(2)与上述顺(反)式脂肪酸互为同系物的最简单物质的结构简式为 。
(3)上述顺式脂肪酸和反式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为 。
A.同分异构体 B.同系物 C.同一种物质 D.同素异形体
(4)研究表明,在特定的条件下,顺式脂肪酸与反式脂肪酸会产生互变,油脂长时间高温加热及油脂催化加氢都会使反式脂肪酸的含量增高。亚油酸(9,12-十八大二烯酸)与氢气以1:1催化加氢过程中,考虑顺、反异构,生成的脂肪酸最多有
种。
(5)据专家介绍,多食用花生油对人体有益,是因为花生油中含反式脂肪酸较少,且含
有对人体有益的白藜芦醇(化学名称为芪三酚),其结构简式为: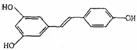
试写出1mol白藜芦醇与足量溴水发生反应的化学方程式:
27.在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水性质。
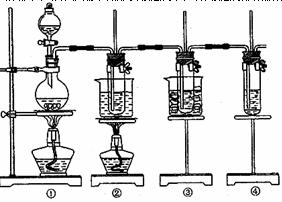
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有
或 (填写化学试剂名称)的净化装置。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异: 。
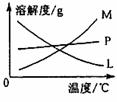
②的试管中反应的离子方程式为 。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为
色 |
氯气与水反应生成的H+使石蕊变化 |
|
随后溶液逐渐变为无色 |
|
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,说明使用何种化学试剂,理由
26.某化学课外兴趣小组探究铜跟浓硫酸的反应情况:
取6.4g铜片和1mol 18mol/L浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时他们根据所学的化学知识认为还有较多的硫酸剩余。
(1)请写出铜跟浓硫酸反应的化学方程式: 。试问:
为什么较多的余酸不与铜继续反应?简述理由:
(2)可以证明有余酸的实验方案一是 。(填写字母编号,多选扣分)
A.再加入足量镁粉 B.再滴入BaCl2溶液
C.再加入银粉 D.再滴入Na2CO3溶液
在上述可证明在余酸的实验方案中,继续通过测定生成气体的量即可确定余酸的浓度,测定方法有多种,方法① ②
(3)可以证明有余酸的实验方案二是:测定反应后混合溶液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应,过滤出沉淀,洗涤,干燥,称量为A克。
写出生成沉淀的离子反应方程式: 。如果在反应后的溶液中直接加入足量Na2S溶液,充分反应后,过滤出沉淀,洗涤,干燥,称量为B克,则B可能 A(填写“大于”“小于”或“等于”),用化学方程式说明原因 。
(4)上述实验方案中,能够计算余酸浓度的数据除测算产生气体的物质的量或反应掉铜的物质的量外,尚缺少的测量数据是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com