
3.下列各组物质反应后,含碳元属的物质既是氧化剂又是还原剂的是 ( )
A.CO2+Na 2O2 B.Mg+CO2 C.CaO+C D.CaCO3+SiO2
2.通入少量CO2,下列溶液能发生反应,但无明显现象的是 ( )
A.澄清石灰水 B.水玻璃 C.苯酚钠溶液 D. 苏打溶液
1.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是 ( )
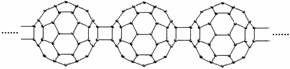
A.常温常压下X为固态且难溶于水
B.一定条件下X可与Cl2发生加成反应
C.X是碳的一种同素异形体
D.X的摩尔质量为720n
29.(10分)当前,一次性筷子、一次性饭盒的安全已受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为使筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
(1)铅的元素符号是 ,它在周期表中的位置是 。
(2)防止或减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。
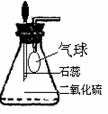
①为研究SO2的溶解性质,某学生做如下实验:如上图,锥形瓶中收集的是SO2,瓶塞系着瘪气球,气球与大气相通。向瓶中滴加紫色石蕊试液,实验现象: 。
②为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,
能说明SO2在水中的溶解度大于CO2在水中溶解度的实验现象是: 。
③某学生用试管取出上述①实验后的瓶中溶液适量,滴入少量品红溶液,充分振荡,实验现象为: ,接着向溶液加入足量氯水,实验现象为: ,再滴加BaCl2溶液,实验现象为: 。
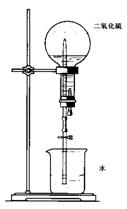
④有人利用SO2易溶于水的性质设计成如图所示的装置进行喷泉实验,但实验效果并不理想。为完成效果明显的喷泉实验,可将水改为 溶液。
(3)制一次性筷子有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥打磨,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为: 。
28.(10分)A-J均为常见物质,A是固体单质,B是淡黄色粉末,C、F、I为气体单质。
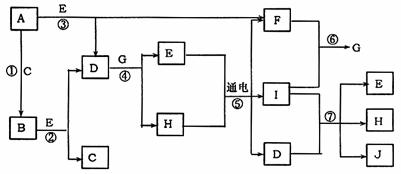
(1)H的电子式 。
(2)反应⑦的离子方程式为 。
(3)向AlCl3溶液中逐渐加入过量D的反应方程式为 。
(4)写出反应②的化学方程式 。
(5)写出实验室制取I的离子方程式 。
27.(11分)如下图所示,U形管内盛有100mL的溶液,请按要求回答下列回答。
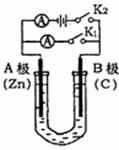
(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,则:A为 极,B极的电极反应式为 。
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,合并K2,则:
①A电极可观察到的现象是 。
②B极的电极反应式为 。
③总反应的化学方程式是 ,
若忽略溶液的体积变化和气体的溶解,反应一段时间后将溶液充分
混合,溶液的pH为12,B极产生气体的体积(标准状况)为 mL。
26.(12分)
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子方程式________________________;在以上中性溶液中,继续滴加Ba(OH)2溶液,写出此反应的离子方程式________________________ 。
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,写出反应的离子方程式________________________;在上述溶液中,继续滴加NaHSO4溶液,写出此反应的离子方程式________________________。
(3)向Ba(OH)2溶液中逐滴加入明矾溶液至Ba2+恰好完全沉淀,其反应的离子方程式
为________________________;在上述溶液中,继续滴加明矾溶液,写出反应的离子方程式________________________。
25.(9分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、
Z,元素X、Y、Z的原子序数依次递增。①元素Y在A、B、C、D、E中所呈化合价依次递增,
其中只有B为单质。②常温下将气体D通入水中发生反应,生成C和E;③工业上以A、空气
和水为原料,通过催化氧化法制取E。请回答以下问题:
(1)B分子中含有化学键为 (写名称);
A的分子式为 ;A分子的空间构型是 。
(2)写出②中涉及反应的化学方程式 。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式
。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式 。
24. 已知:2SO2(g)+O2(g)
2SO3(g);△H=-196.6kJ/mol下列有关硫酸工业的说法不正确的是 ( )
已知:2SO2(g)+O2(g)
2SO3(g);△H=-196.6kJ/mol下列有关硫酸工业的说法不正确的是 ( )
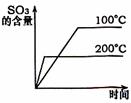
A.上图可以表示SO3的含量与时间、温度的关系
B.工业条件选择400℃~500℃,不符合勒夏特列原理
C.平衡时容器内SO2、O2、SO3物质的量之比为2:1:2
D.常压下SO2转化率已经很高,并不需要加压
|
23.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸得酸性混合液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)<c(NO3-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com