
5、设NA为阿伏加德罗常数,下列叙述中正确的是
A.在标况下,完全燃烧2.24L辛烷可生成CO2分子数为0.8NA;
B.标况下22.4L正戊烷含氢原子数为12NA;
C.1mol -OH所含的电子数为17NA;
D.1L1mol/L的硫酸铵溶液中铵根离子数会小于2NA;
4、下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石):ΔH = +119 kJ· mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H++OH-===H2O;ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l);ΔH=+285.8 kJ· mol-1
3、已知铋酸钠(NaBiO3)在酸性条件下可以将Mn2+氧化成MnO4-,则下列溶液中不能用于酸化铋酸钠溶液的是
A.HNO3 B.NaHSO4 C.HCl D.H2SO4
2、有关氯化铁溶液与氢氧化铁胶体的性质的叙述中错误的是( )
A.FeCl3溶液稳定,而Fe(OH)3胶体则不稳定; B.加入烧碱溶液均有沉淀析出;
C.加热蒸干,灼烧后均有氧化铁生成; D.都能透过滤纸。
1、实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯 ②固定铁圈位置③放上蒸上皿 ④加热搅拌 ⑤停止加热、余热蒸干。其正确的操作顺序是:
A.②③④⑤ B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
31.(6分)将4 mol SO2和2 mol O2气体在容积为2L的密闭容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g)  2SO3
(g)。若反应2s后,测得SO3的浓度为0.6 mol/ L,试计算:
2SO3
(g)。若反应2s后,测得SO3的浓度为0.6 mol/ L,试计算:
(1)这段时间内,用氧气表示的反应速率 = ;
(2)反应了的SO2占原有SO2的分数 = ;
(3)2s时的O2浓度 = 。
30.(10分)选择适宜的材料和试剂设计一个原电池,以便完成下列反应。
Cu + Fe2(SO4)3 = 2FeSO4 +CuSO4
(1)请指出正极材料、负极材料、电解质溶液(写化学式)
正极: 负极: 电解质溶液:
(2)写出电极反应式:
正极: 负极:
29.(6分)在容积为2L的密闭容器中,某反应在0-2分钟进行反应的过程中,在不同反应时间,各物质的量的变化情况如图所示(A、B、C均为气态物质)。
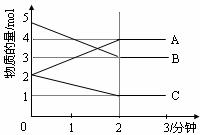
(1)化学反应方程式为 ;
(2)反应开始至2分钟时,用C表示的化学反应速率为 ;
(3)压缩体积,对反应速率是否有影响 (填“有”或“无”)。
28. (12分)A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B原子的最外层只有一个电子,C的原子结构示意图为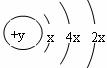 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为 ,其气态氢化物的化学式为 ;
(2)D在周期表的 周期, 族;
(3)A、B、C、D四种元素的原子半径由大到小的顺序为(用化学式填写) ;
(4)B的最高价氧化物的水化物的化学式为
27.(6分)已知31g白磷变为31g红磷时会释放能量。试回答:
(1)上述变化属于 变化;
(2)31g白磷具有的能量 (填“>”或“<”,下同)31g红磷具有的能量;
(3)31g白磷完全燃烧释放出的能量 31g红磷完全燃烧释放的能量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com