
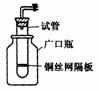
25.(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体________________________.若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________.写出反应的离子方程式__________________.
(2)①写出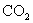 和
和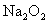 反应的化学方程式______________________.
反应的化学方程式______________________.
②某学生判断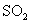 和
和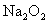 反应能生成硫酸钠,你认为他的判断合理吗?________.简要说明理由:______________________.
反应能生成硫酸钠,你认为他的判断合理吗?________.简要说明理由:______________________.
③该同学无法断定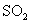 和
和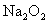 反应中是否有氧气生成,拟使用下列装置进行实验.
反应中是否有氧气生成,拟使用下列装置进行实验.
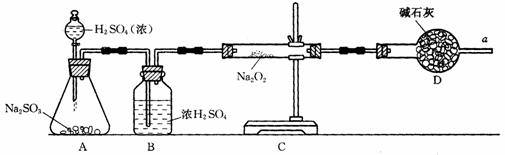
装置中B的作用是_______________,D的作用是_______________.
④为确认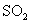 和
和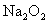 反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________.
反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________.
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧.
B.将C装置中反应后的固体物质溶于适量水配成溶液.
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成.
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
24.(10分)多硫离子Sx2-(x是2-6的整数)在碱性溶液中被BrO3-氧化成SO42-,BrO3-自身被还原成Br-。
(1)该反应的离子方程式是(要配平)
(2)该反应中Sx2-作还原剂。每1mol Sx2-失去 mol电子。
(3)若通过测定BrO3-与OH-的用量情况来确定x的值,至少需要确定以下A-C中的
才能确定Sx2-中的x的值.
A.BrO3-或OH-的绝对用量 B.BrO3-与OH-的绝对用量 C.两者用量比
(4)多硫化钠是一种重要的多硫化物,利用反应2Na+xS Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的 极相连接。
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的 极相连接。
23.(6分)(1)①家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50KJ。试写出丁烷燃烧反应的热化学方程式 _。
②又已知H2O(l)=H2O(g);△H=+44kJ/mol,则58g丁烷完全燃烧生成气态水时放出热量
为 KJ。
(2)已知含KOH28.0g稀溶液与足量稀硫酸反应,放出28.65KJ的热量,试写出该反应中和热的热化学方程式 。
22.(6分)已知RxO42-+MnO4-+H+-RO2+Mn2++H2O的变化过程中,有0.2molRxO42-离子参加反应时,共转移0.4mol电子.
(1)反应的氧化产物为 ;
(2)x= ;
(3)参加反应的氢离子的物质的量为 .
21.(12分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
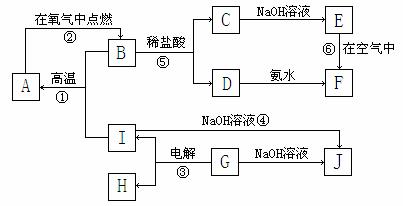
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_______周期、第_______族 ;
(2)写出反应①的化学方程式___________ _________;
(3)写出反应④的离子方程式_____________ _______; (4)写出反应③的电极方程式:
阳极:_______________ _____ 阴极:____________ __________
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
20.(16分)有一纯净的亚硫酸钠晶体因部分被氧化而变质,为了测定样品中杂质的质量分数,现设计下列实验过程,按要求填写空格:
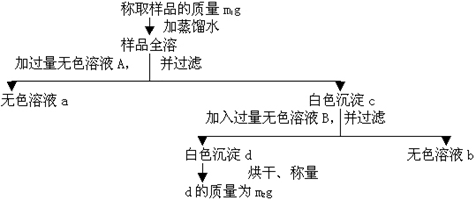
(1)向混合溶液中加入的无色溶液A是____ __,A必须过量的原因是 。
(2)白色沉淀C中含有____ ___。
(3)无色溶液B通常是____ ___溶液,加入后与C反应的离子方程式为____ ___;
若无色溶液B是硝酸溶液或硫酸溶液,是否能测定样品中杂质的质量分数?________(填是或否);请简要说明理由:
① ② ③
(可不填满也可补充)
(4)通过以上测定可得到样品中杂质的质量分数的计算式为____ _____。
19.(6分)某溶液中可能含有下列离子中的两种或几种:Ba2+、H+、SO42-、 SO32- 、HCO3-、 Cl-。
(1)当溶液中有大量H+存在时,则不可能有 离子存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有 离子存在。
(3)采用惰性电极从上述离子中选出适当离子组成易溶于水的电解质,对其溶液进行 电解若两极分别放出气体,且体积比为1∶1,则电解质化学式是________________。
18.用惰性电极电解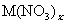 的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),则可知M的原子量为:.
的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),则可知M的原子量为:.
A.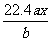 B.
B.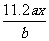 C.
C.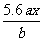 D.
D.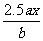
17.有关下图装置中的叙述正确的是
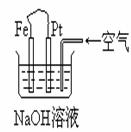
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
16.在4mol/L 的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后,
最多可收集到标况下的气体的体积为
A.89.6mL B.112mL C.168mL D.224mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com