
21.(16分)下图是元素周期表中的前四周期。现有①-⑥六种元素,在元素周期表中的位置如图所示,试回答下列问题:
|
① |
|
|
|||||||||||||||
|
|
|
|
|
③ |
④ |
|
|
|
|||||||||
|
② |
|
|
|
|
|
⑤ |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑥ |
|
⑴上述六种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中燃烧的化学方程式为 。
⑵元素①和③可以形成众多的化合物,其中最简单的是 (写化学式),
该化合物中,化学键的类型为 。
⑶元素④的最高氧化物的水化物,其稀溶液能与Cu发生反应,反应中该稀溶液的作用是
。
⑷元素⑤的最外层电子数为 ;元素⑤和⑥相比,非金属性强的是 ,能说明该结论的化学事实为 (用离子方程式表示)。
22.(12分)可用图示装置制取少量乙酸乙酯,请填空:
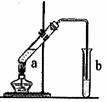
(1)试管a中需加入浓硫酸、乙酸和乙醇各2mL,正确的加入顺序与操作是:
为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是:
(2)写出a中反应的化学方程式,并注明反应类型
、
(3)实验中加热试管的目的是:
①
②
(4)试管b中装有饱和Na2CO3溶液,其作用是(填字母编号)
A.中和乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)试管b中的导管未插入液面下,原因是:
若要把试管b中制得的乙酸乙酯分离出来,应采用的实验操作是
23.(18分)利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水,等等。
20.电子表电源常用微型银-锌电池,电极分别是Ag2O和Zn,电解液为KOH溶液,电极反应为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO,根据上述变化下列判断正确的是:
A.Zn是负极,Ag2O是正极
B.Zn是正极,Ag2O是负极
C.工作时电子由Ag2O极经外电路流向Zn极
D.工作时,电池负极区溶液OH-浓度增大
19.下列说法中,可以证明反应N2+3H2 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
A.1个N≡N键断裂的同时,有6个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
18.据报道,某国一集团拟在太空建造巨大的集光装置,把太阳光变成激光用于分解海水制氢气,下列说法中正确的是
A.使用氢气作燃料的突出优点是携带方便
B.氢气是一级能源
C.可以研究高效催化剂使水分解产生氢气同时放出热量
D.若用生成的氢气与空气中多余的CO2反应生成甲醇(CH3OH)储存起来,可以改善生存环境
17.根据下表信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
16.煤的干馏和石油分馏的本质区别在于
A.温度不同 B.产品不同
C.前者隔绝空气加强热,后者不隔绝空气加热 D.前者是化学变化,后者是物理变化
15.下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是
A.3和17 B.1和8 C.1和6 D.7和12
14.下列说法正确的是
A.SiH4比CH4稳定
B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
13.下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的组序数
B.除第一周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
12.下列说法错误的是
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为可逆反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com