
1.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
27.生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO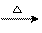 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5g。
⑴原混合气体中甲烷的物质的量是 。
⑵原混合气体中氮气的体积分数为多少?(写出计算过程)
26.(12分)Ⅰ、已知X、M、N为周期表中1-20号元素,
(1) X的最高正化合价与最低负化合价的代数和为4,且X在最高价氧化物中的质量分数为40%,则X在周期表中的位置是________________________;
(2)4.5 g金属单质M与足量的硫酸溶液完全反应放出氢气,电子转移的个数为3.01×1023,则该金属M是___________;
(3) N元素的同位素AZN,它的氯化物NCl2 2.22 g溶于水制成溶液后,加入2 mol·L-1的AgNO3溶液20 mL,恰好完全反应。若这种同位素原子核内有20个中子,则Z=____________。
Ⅱ、把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:
4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1,则前2 min内用X的浓度变化表示的平均反应速率为
;2 min末时Y的浓度为 ;n= 。
25. (10分)石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示。在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液。
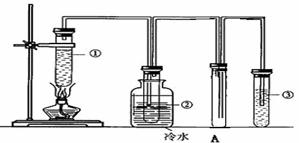
实验现象:
试管①中,加热一段时间后,可以看到试管内液体沸腾;
试管②有少量液体凝结,闻到汽油的气味;往液体滴加几滴高锰酸钾酸性溶液颜色褪去;
试管③中的有气泡放出;溴的四氯化碳溶液颜色逐渐褪去。
根据实验现象,回答问题:
(1)装置A的作用是: 。
(2)写出试管③中反应的一个化学方程式: ,
该反应的反应类型为 。
(3)试管②中的少量液体的组成是 (填序号)
A.甲烷 B.乙烯 C.液态烷烃 D.液态烯烃
(4)丁烷是由石蜡油分解的过程中的中间产物之一,写出它的两种同分异构体的结构简式:________________________________________________。
24.(12分)元素周期表是学习化学的重要工具,它隐含许多信息和规律。
下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)。
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/nm |
0.16 |
0.143 |
0.102 |
0.099 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分)。
(2)B元素处于周期表中 周期 族;
(3)在元素周期表中 的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是 (填化学式);
(5)用电子式表示A、D形成化合物的过程 ;
(6)C、E形成化合物为 (填化学式),含化学键类型为 。
23.(12分) 实验Ⅰ:50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
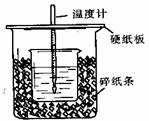
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (选填“偏大”、“偏小”、“无影响”)。
实验Ⅱ:测定锌与稀硫酸反应的速率。
测定该反应速率的方法有多种,不同的方法需要测定不同的数据。请根据你设计的测定方法,填写需要记录的数据及其单位:
① ,单位 ;
② ,单位 。
根据你测定的实验数据,处理后可求得________(填化学式)的反应速率,单位是_________。
22.(12分)某实验小组用下列装置进行乙醇催化氧化的实验。
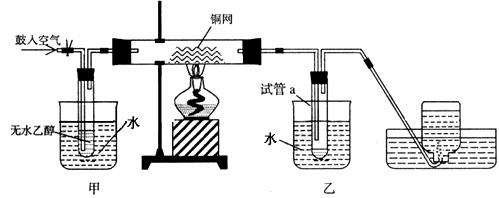
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应。
⑵甲和乙两个水浴作用不相同。
甲的作用是 ;乙的作用是 。
⑶反应进行一段时间后,干燥管a中能收集到不同的物质,它们是 。集气瓶中收集到的气体的主要成分是 。
⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
。要除去该物质,可现在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填试验操作名称)即可除去。
21.(12分)下列物质的转化或分离是用哪种方法实现的?
A.溶解 B.裂解 C.分馏 D.裂化 E.干馏 F.蒸馏 G.电解
H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质
20.从绿色化学的理念出发,下列实验不宜用下图所示装置进行的是
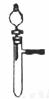
A.不同浓度的硝酸与铜的反应
B.稀硫酸与纯碱或小苏打反应
C.铝与氢氧化钠溶液或稀盐酸反应
D.H2O2在不同催化剂作用下分解
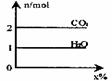
19.将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的物质的量(n)与甲在混合液中的质量分数(x%)关系如下图所示,则甲、乙组合正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com