
28.(7分)某硫酸厂在进行黄铁矿(主要成分是FeS2)成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:①SO2+2Fe2++2H2O=SO2- 4+2Fe3++4H+
②___ Cr2O2- 7+___ Fe2++___ H+=___ Cr3++____ Fe3++_____ H2O
⑴在反应②的横线上填写相应的化学计量数。
⑵若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,写出SO2气体转化为SO3的热化学方程式:___________________________________________。
⑶求样品中的质量分数(假设杂质不参加反应),写出计算过程。
27.(4分)250℃时将24.8gNaOH和NaHCO3的混合物放在密闭容器中加热,充分反应后,称得剩余固体的质量为23g。请回答:
⑴NaOH和NaHCO3的物质的量之比为______1(填>、<或=)。
⑵NaOH的物质的量为_______________。
26.(13分)Ⅰ.硫酸的消费量常被作为有关国家工业发达水平的一种标志,下表为接触法制硫酸时,温度和压强对SO2转化率的影响:
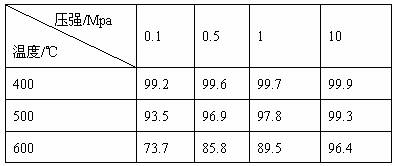
⑴硫酸工业在国民经济中占有重要的地位,请写出它的两种重要用途:
___________________、_____________________。
⑵工业中催化氧化SO2采用常压而不用高压,理由是__________________________。
Ⅱ.实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并收集得到SO3。已知SO3熔点为16.8℃,沸点44.8℃,且SO3遇水剧烈反应。
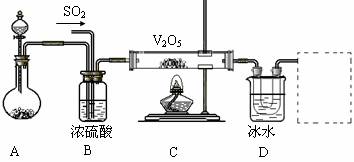
⑴写出A装置中制取氧气的化学方程式__________________________________。
⑵B装置的作用除了将气体充分混合外,还有:
①________________________________,②_________________________________。
⑶加热硬质玻璃管时,若不断升高温度,对SO2和O2生成SO3的化学反应有何影响:
_____________________________________________________________。
⑷本实验装置虚框处还需接一装置,甲、乙、丙三同学分别设计了a、b、c三套装置,你认为不合理的是________,理由是______________________________________。

25.(4分)下列实验基本操作或说法正确的是______(填写序号)。
①如果硝基苯或苯酚浓溶液沾到皮肤上,应立即用氢氧化钠溶液冲洗;
②25℃时测得CH3COONa溶液的pH大于7,即可证明醋酸为弱酸;
③石蕊试纸或pH试纸使用前都应用蒸馏水润湿;
④浓硝酸或氢氟酸都应保存在棕色细口玻璃试剂瓶中;
⑤在石油的分馏实验中,温度计需插入液体中;
⑥容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响;
⑦向沸腾的氢氧化钠溶液中滴加少量饱和氯化铁溶液以制取氢氧化铁胶体。
24.(8分)从有机物A出发可发生下图所示的一系列反应。已知A分子中苯环上只有两个取代基且连在相邻的碳原子上。
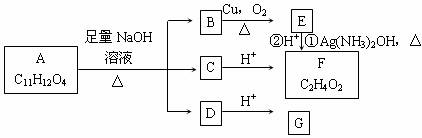
试回答:
⑴A的结构简式________________________________。
⑵B→E的化学方程式___________________________________________。
⑶G不能发生的反应是_______________________(填序号)
①取代反应 ②氧化反应 ③消去反应 ④加成反应
⑷G和苯酚的混合物共xmol,完全燃烧标准状况下O2aL,则生成水______mol。
23.(8分)有机化合物A为一元溴代有机酸,仅含C、H、O、Br元素,与A相关的反应框图如下:

⑴写出下列反应的有机反应类型:
A→C中是_______反应,C→E是_________反应。
⑵写出F的结构简式:_______________________________________。
⑶写出与C具有相同官能团的同分异构体的结构简式__________________________。
⑷写出下列反应的化学方程式
A→B:_____________________________________________________。
22.(8分)有一结晶水合物X·6H2O,其水溶液为浅绿色,可发生如下的转化(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,G为难溶于水的红褐色固体。在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀。
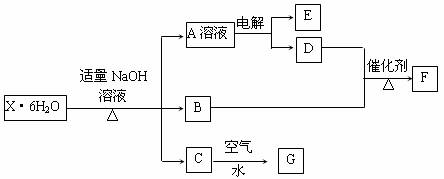
请回答下列问题:
⑴指出C→G的基本反应类型:_________反应。
⑵用惰性电极电解溶液A时得到E的电极反应式为____________________________。
⑶B与D反应生成F的化学方程式为__________________________________。
⑷该晶体水合物的化学式为_________________________________。
21.(8分)A、B、C、D、E为前20号元素,原子序数依次增大,其中A、D同主族,B、C、D同周期,B、C、D最高价氧化物对应的水化物均能相互反应生成盐和水。A、B、E的单质均能和水剧烈反应,E+与D的阴离子具有相同的电子层结构。
⑴A、B、C、D四种元素的原子半径由小到大的顺序是________________(用元素符号表示)。⑵A和D的氢化物中__________(用化学式表示)的沸点较高,原因是_______________________________________。
⑶写出E单质与水反应的离子方程式__________________________________________。
⑷B和D形成的晶体中,每个阳离子与它最近且等距的阳离子共有__ _个。
20.可逆反应:mA(g) +nB(g) pC(g)+qD(g)在温度T1、T2,压强P1、P2下,产物D的物质的量n与反应时间t的关系如右图所示。下列各项中不正确的是( )
pC(g)+qD(g)在温度T1、T2,压强P1、P2下,产物D的物质的量n与反应时间t的关系如右图所示。下列各项中不正确的是( )

A. T1< T2 B. P1<P2
C.正反应为放热反应 D.m+n<p+q
第Ⅱ卷(非选择题,共60分)
|
19.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.标准状况下,22.4L己烷中共价键数目为19NA
B.0.1mol铁与足量硫粉充分反应,转移的电子数为0.3 NA
C.1mol/L的Na2CO3溶液中含有NA个CO2- 3
D.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com