
3.物质分类的依据通常是根据它的组成和性质,下列物质的分类中,只考虑组成的是( )
A.硫酸钠是钠盐、硫酸盐、正盐 B.二氧化硫是氧化物、酸酐、有漂白性物质
C.氢氧化钠是一元碱、易溶性碱、强碱 D.碳酸氢钠是钠盐、酸式盐、易分解的盐
2.下列不存在丁达尔效应的分散系是 ( )
A.有尘埃的空气 B.纯水
C.食盐水 D.向沸水中滴入FeCl3饱和溶液所得液体
1.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.CO2
21.(5分)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60
mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60
mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为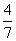 。计算
。计算
① 该条件下N2的平衡转化率;
② 该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
20.(12分)t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 。
(2)x= ;平衡常数K= 。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) 。
A.向正反应方向移动 B. 向逆反应方向移动 C. 不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
19.(10分) 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:
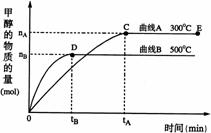
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
18.(6分)现将0.4molA气体和0.2molB气体充入10L 的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如下图:
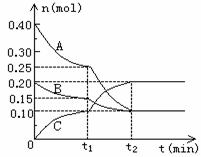
(1)若t1=10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时刻达到平衡,则其化学反应方程式为 。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是 。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
17.(14分)
(1)下表是一些共价键的键能
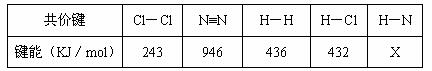
①下列物质本身具有的能量最低的是 ( )
A.Cl2 B.N2 C.H2 D.NH3
② 已知:N2(g)+3H2(g) 2NH3
△H=-92.4KJ·mol-1,则X为 。
2NH3
△H=-92.4KJ·mol-1,则X为 。
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式: 。若1g水蒸气转化为液态水放热2.44KJ,则反应H2(g)+1/2O2(g)=H2O(l) △H= KJ·mol-1,氢气的燃烧热为 。
(3)已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-25KJ/mol;3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47KJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+19KJ/mol;计算
FeO(s)+CO(g)=Fe(s)+CO2(g) 反应的反应热△H= 。
(4)已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式 。
16.(8分)CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在101KPa时,CO的燃烧热为283KJ/mol。相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,CH4完全燃烧反应的热化学方程式是 。
(3)120℃、101KPa下,a ml由CO、CH4组成的混合气体在b mlO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mlCO2,则混合气体中CH4的体积分数为 (保留2位小数)。
②若燃烧后气体体积缩小了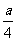 ml,则a与b关系的数学表示式是 。
ml,则a与b关系的数学表示式是 。
15.在相同温度和压强下,对反应CO2(g)+H2(g)=CO(g)+H2O (g)进行甲、乙、丙、丁四组实验,,实验起始时放入容器内各组分的物质的量见下表
|
物质的量 |
CO2 |
H2 |
CO |
H2O |
|
甲 |
a mol |
a mol |
0 mol |
0 mol |
|
乙 |
2a mol |
a mol |
0 mol |
0 mol |
|
丙 |
0 mol |
0 mol |
a mol |
a mol |
|
丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙=丁>丙=甲 B乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com