
31.(8分)[化学--化学与技术]
氯碱工业中,通过电解饱和食盐水获得重要的化工原料,其产物中的氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、聚氯乙烯、氯苯等。
(1)下图为电解饱和食盐水的简易装置,下列有关说法正确的是
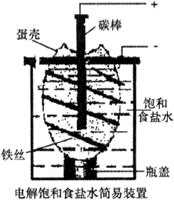
A.蛋壳表面缠绕铁丝发生氧化反应
B.蛋壳充当隔膜作用,可阻止生成的氯气与氢气、氢氧化钠溶液接触
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.电解一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色
(2)氯气或氯化氢还可用于制造芯片的材料--高纯硅,其生产流程图如下:
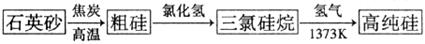
①写出由粗硅转化为三氯硅烷(SiHCl3)的化学方程式____________________。
②若把氧气和四氯化硅蒸气的混合物气体在1573K的高温下反应,并在1900-2000℃的高温下,熔化拉制,得到粗细均匀的光纤。写出该反应的化学方程式________________________________________。
③用化学方程式表示氢氟酸蚀刻玻璃的原理:______________________________。
(3)PVC塑料(聚氯乙烯)是用途十分广泛的石油化工产品。某化工厂曾利用反应①、②生产聚氯乙烯的单体氯乙烯: ①,
①,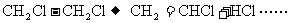 ②。该工厂后来将反应③应用于生产:
②。该工厂后来将反应③应用于生产: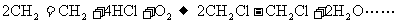 ③。由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯,形成了新的工艺,该工艺流程的特点是__________________________________________________。
③。由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯,形成了新的工艺,该工艺流程的特点是__________________________________________________。
(4)下列各项属于“绿色化学”的是
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源
30.(14分)已知下列物质的物理常数如下:乙酸:熔点16.6℃,沸点117.9℃。乙醇:熔点-117.3℃,沸点78.5℃。乙酸乙酯:熔点-83.6℃,沸点77.1℃。
(1)下图为课本上制取乙酸乙酯的实验装置图,请回答下列问题:
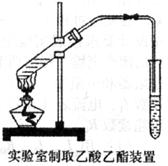
①实验室制备乙酸乙酯的化学方程式为___________________________;
②用上述装置制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有_____________________________________________;
(2)某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如下图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液。试回答:
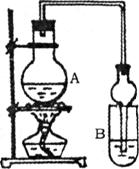
①A中浓硫酸的作用是__________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:_________ ___________________________。
②B中球型干燥管的两个作用是__________________、__________________。若反应前向B中溶液滴加几滴酚酞,呈红色,产生此现象的原因是(用离子方程式表示)__________________;反应结束后B中的现象是__________________。
③从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出___________(填写名称);再加入(此空从下列选项中选择)_________,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为: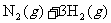

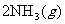 ;
;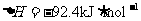
①673K,30MPa下,上述合成氨反应中,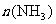 和
和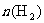 随时间变化的关系如下图所示。下列叙述正确的是__________。
随时间变化的关系如下图所示。下列叙述正确的是__________。
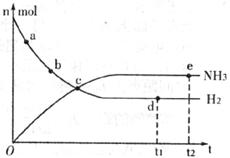
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的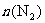 相同
相同
D.773K,30MPa下,反应至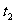 时刻达到平衡,则
时刻达到平衡,则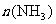 比图中e点的值大
比图中e点的值大
②在容积为2.0L恒容的密闭容器中充入0.80mol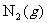 和1.60mol
和1.60mol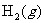 ,反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应
,反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应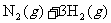

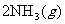 的平衡常数
的平衡常数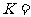 __________。
__________。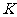 值越大,表明反应达到平衡时__________(填标号)。
值越大,表明反应达到平衡时__________(填标号)。
A.H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
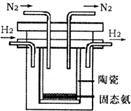
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递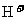 ),实现了高温常压下高转化率的电解合成氨。其实验装置如下图。阴极的电极反应式____________________。
),实现了高温常压下高转化率的电解合成氨。其实验装置如下图。阴极的电极反应式____________________。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量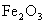 的
的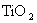 )表面与水发生下列反应:
)表面与水发生下列反应: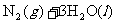

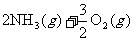
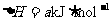 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
NH3生成量/(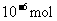 ) ) |
4.8 |
5.9 |
6.0 |
①合成反应的 ,
, ;(填“>”、“<”或“=”)
;(填“>”、“<”或“=”)
②已知: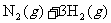

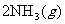 ;
;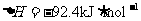
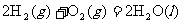 ;
;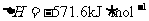
则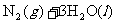

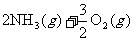 ;
;
28.(14分)铜是一种重要的金属元素,铜元素与银元素同处第ⅠB族,+1价的铜和+1价的银都可形成二配位的络离子,如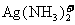 、
、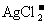 、
、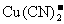 等,含铜最丰富的自然资源是黄铜矿(
等,含铜最丰富的自然资源是黄铜矿(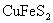 )。
)。
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜,完成下列2个化学方程式:
①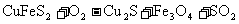
②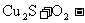
(2)但是,这种方法的缺点是副产物SO2会导致大气的污染,同时要消耗大量的热能。
现有一种湿法冶炼技术,其步骤是:
①用FeCl3、CuCl2的混合液处理富铜矿砂,使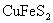 中的Cu转变为难溶的氯化物A,硫元素转变为硫单质沉淀;
中的Cu转变为难溶的氯化物A,硫元素转变为硫单质沉淀;
②将沉淀分离出来,用氯化钠溶液处理所得的沉淀物,使A溶解变成化合物B,从而和硫单质分离;
③控制条件使B在溶液中通过歧化反应生成铜,母液中的一种成分可以在处理铜矿砂时循环使用。
回答下列问题:
(1)指出A、B各是什么物质。A__________;B__________。
(2)写出①、③步中反应的化学方程式。
15.已知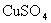 溶液分别与
溶液分别与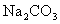 溶液、
溶液、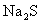 溶液的反应情况如下:
溶液的反应情况如下:
(1)
主要: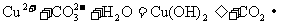
次要: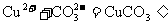
(2)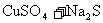
主要: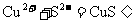
次要: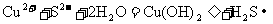
下列几种物质溶解度大小比较中。正确的是
A.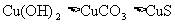 B.
B.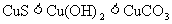
C.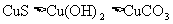 D.
D.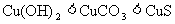
第Ⅱ卷
[必做部分]
14.有机物A和B均由C、H、O三种元素中的两种或三种组成,关于A、B两种物质的燃烧,其中正确的是
A.质量相等的A、B燃烧生成等质量的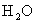 ,则可推知A、B具有相同的最简式
,则可推知A、B具有相同的最简式
B.物质的量相等A、B燃烧生成等质量的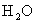 、
、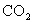 ,则A、B必然互为同分异构体
,则A、B必然互为同分异构体
C.质量均相等的A、B燃烧生成等质量的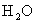 、
、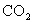 ,则A、B必然互为同分异构体
,则A、B必然互为同分异构体
D.物质的量相等的A、B燃烧耗氧量、生成的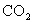 均相等,则两者分子组成相差若干个“
均相等,则两者分子组成相差若干个“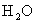 ”
”
13.下列反应的离子方程式不正确的是”
A.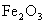 溶于过量的氢碘酸中:
溶于过量的氢碘酸中: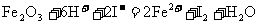
B.向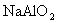 溶液中通入过量
溶液中通入过量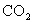 :
: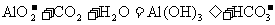
C.向漂白粉溶液中通入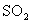 气体:
气体:
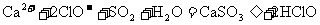
D.向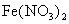 溶液中加入稀盐酸:
溶液中加入稀盐酸: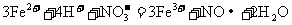
12.下表中的实验,“操作和现象”与“结论”对应关系正确的一组是
|
|
操作和现象 |
结论 |
|
A |
向纯碱中滴加足量浓盐酸,将所得气体直接通入苯酚钠溶液中,溶液变浑浊 |
酸性:盐酸>碳酸>苯酚 |
|
B |
取某溶液少量,加入盐酸酸化的BaCl2溶液,出现白色沉淀 |
该溶液中一定含有大量的SO2 |
|
C |
取少量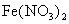 试样加水溶解后加稀 试样加水溶解后加稀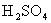 酸化,滴加KSCN溶液,溶液变为红色 酸化,滴加KSCN溶液,溶液变为红色 |
该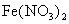 试样已经变质 试样已经变质 |
|
D |
取皂化反应后的混合液滴入盛水的烧杯中,在液体表面出现油滴 |
皂化反应不完全 |
11.以铂为电极,电解含有0.10mol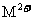 和0.10mol
和0.10mol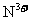 的溶液,阴极析出固体的物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如下图。下列说法正确的是
的溶液,阴极析出固体的物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如下图。下列说法正确的是
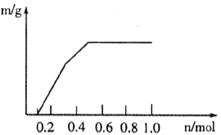
A.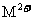 和
和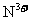 的氧化能力均小于
的氧化能力均小于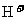
B.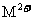 和
和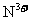 可能分别是和
可能分别是和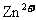 和
和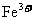
C.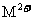 和
和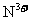 可能分别是
可能分别是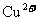 和
和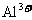
D.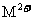 和
和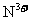 可能分别是
可能分别是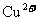 和
和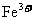
10.短周期元素X、Y、Z的离子具有相同的核外电子排布,原子半径X大于Z,离子半径Y大于Z,Y与Z可形成常见的离子化合物,则下列说法中不正确的是
A.原子序数一定是Z>X>Y
B.X、Z两种元素的单质的沸点一定是Z>X
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com