
5、下列各组离子能在指定环境中大量共存的是( )
A.在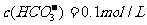 的溶液中
的溶液中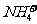 、
、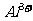 、
、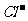 、
、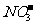
B.在由水电离出的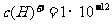
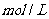 的溶液中
的溶液中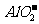 、
、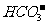 、
、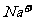 、
、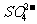
C.PH=1的溶液中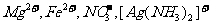
D.在使红色石蕊试纸变蓝的溶液中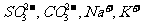
4、某无色溶液,由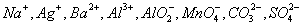 中的若干种组成。取该溶液进行如下实验:①取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;②在①所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有( )
中的若干种组成。取该溶液进行如下实验:①取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;②在①所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有( )
A.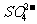 、
、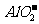 、
、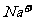 B.
B.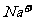 、
、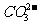 、
、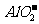
C.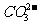 、
、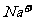 、
、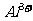 D.
D.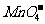 、
、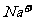 、
、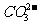
3、下列反应中符合图示能量变化的是( )
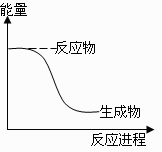
A.电解Al2O3得到Al和O2
B.HCl分解为H2和Cl2
C.Na与水反应
D.工业上用H2还原Fe2O3制Fe
2、据认为,铜制避孕环的避孕机理之一是铜与子宫分泌物中的盐酸以及子宫内的空气发生反应:Cu+HCl+O2===CuCl+HO2,生成的HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性,能杀死精子。下列说法或表示中正确的是( )
A.上述反应中氧化剂是O2
B.HO2在碱溶液中能稳定存在
C.上述反应中氧化产物是HO2
D.上述反应中1mol Cu参加反应有2mol 电子发生转移
1、KOH是我国古代纺织业常用做漂洗的洗涤剂,古代制取KOH的流程如下:
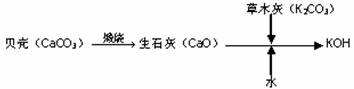
在上述流程中没有涉及的化学反应类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
25.(10分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
(1)提出猜想:甲同学认为二者发生氧化还原反应,其反应的离子方程式为:____________;
乙同学认为发生双水解反应,其反应方程式为:
2 Fe3++3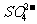 +6H2O=2Fe(OH)3(胶体)+3H2SO3;
+6H2O=2Fe(OH)3(胶体)+3H2SO3;
(2)实验验证:丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是_________。
②取5mLFeCl3溶液于试管中,逐滴加入没变质的Na2SO3溶液至过量,观察到溶液的颜色由黄色变为红褐色(无气泡产生,也无沉淀生成)。
③向②所得的溶液中,加入稀盐酸至过量,再加入,BaCl2稀溶液,有白色沉淀生成;
(3)得出结论:
根据丙同学的实验得出的结论是:___________________________;
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是____________。
②从形式上看,Na2CO3和N Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解力较CO32-,还有___________。
24.(10分,每空2分)在一定温度下,把2molSO4和1molO2通入一个定容积的密闭容器中,发生了如下反应:2 SO2+ O2 2SO3,当反应达到一定的程度时,反应混合物处于一定的平衡状态,现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证反应达平衡时,反应混合物中三种气体的百分含量仍与上述平衡相同。
2SO3,当反应达到一定的程度时,反应混合物处于一定的平衡状态,现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证反应达平衡时,反应混合物中三种气体的百分含量仍与上述平衡相同。
(1)若a=0,b=0,则c=____________。
(2)若a=0.5,则b=__________;c=______________。
(3)a、b、c取值必须满足的一般条件是(请用两个方程表示,其中一个只含a和c,另一个只含b和c)。答案:___________________、_______________________。
23.(8分)如图表示个电解一电池,装有电解液a:X、Y是两块电极板,通过导线与直流电源相连。请回答:
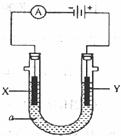
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,写出实验开始时的电极反应式:
①X是极:______________。
②Y是极:_______________。
(2)若X、Y都是惰性电极,a是饱和CuSO4溶液,写出实验开始时的电极反应式:
①X电极:__________。②Y电极:__________。
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液, 则:
①X电极的材料是___________。电极反应式是_____________。
②Y电极的材料是___________。电极反应式是_____________。
说明:杂质发生的电极反应不必写出。
22.(9分)向一密闭容器中充入1mol A,2mol B,发生如下反应:
A(g)+2B(g) C(s)+3D(g)在一定条件下达到平衡,测得混合气体D的物质的量浓度为1.4mol/L;据此回答下列各题:
C(s)+3D(g)在一定条件下达到平衡,测得混合气体D的物质的量浓度为1.4mol/L;据此回答下列各题:
(1)若压缩容器增大压强,则逆反应的速率________;(填“增大”、“减小”或“不变”下同)容器中D的物质的量浓度_______。
(2)若温度升高时,混合气体的质量会增大,则正反应为_________;反应(填“吸热”或“放热”)。
21.(3分)由氢气和氧气反应生成0.5moll液态水放热120.9kJ,写出表示氢气燃烧热的热化学方程式:________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com