
9.若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的方程式是:
2NaCl=2Na+Cl2↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为H2O
C.该装置只能是电解池,且可以用Pt为该电解池的阳极
D.该装置只能是电解池,且电解质溶液为H2O
8.一定温度下的难溶电解质在水溶液中达到沉淀溶解平衡时,其平衡常数KSP=cm(An+)× cn(Bm-),称为难溶电解质的离子积,在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀,已知有关物质的颜色和溶度积如下;
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
KSP (250C) |
1.8×10-l0 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和溶液AgCl、AgI、Ag2S中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
7.密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v(B)=3 v(A)、2 v(C)=v(A)。则此反应可表示为
A.3A+2B=6C B.2A+3B=2C
C.2A+3B=C D.3A+2B=2C
6.在0.1mol·L-1NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ +OH-。对于该平衡,下列叙述中正确的是
NH4+ +OH-。对于该平衡,下列叙述中正确的是
A.降低温度,溶液中c(NH4+)增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1 mol·L-1HCl溶液,溶液中c(OH-)增大
D.加入水时,溶液中c(OH-)/c(NH3·H2O)增大
5.实验表明,在一定条件下,乙烯和水的反应可表示为:
C2H4(g)+H2O(g)=C2H5OH(g) △H=一45.8 kJ/mol
则下列说法中正确的是
A.实验中,乙烯的用量不会影响该反应的反应焓变△H
B.0.5 mol H2O(1)完全反应放出的热量为22.9kJ
C.1 mol C2H5OH(g)具有的能量大于C2H4 (g)和1 mol H2O(g)所具有的能量和
D.1mol于C2H4(g)和1mol H2O (g)中化学键的总键能大于l mol C2H5OH(g)中化学键的总键能
4.对于处于化学平衡状态的反应C(s)+H2O(g) CO(g)+H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
CO(g)+H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
A.增大H2O(g)的浓度 B.降低压强
C.升温 D.使用合适的催化剂
3.下列变化中属于吸热反应的是
A.葡萄糖在人体内缓慢氧化 B.灼热的炭和二氧化碳气体化合
C.铝粉与氧化铁粉末反应 D.过氧化钠与水的反应
2.化学平衡主要研究下列哪一类反应的规律
A.可逆反应 B.化合反应 C.离子反应. D.气体反应
1.下列化合物中属于弱电解质的是
A.BaSO4 B.HCl C.CO2 D.H2O
31.(7分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
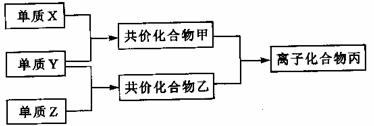
已知:a. 常见双原子单质分子中,X分子含共价健最多。
b. 甲分子含10个电子,乙分子含18个电子,且甲乙相遇可产生大量白烟。
(1)X的结构式是 ,化合物丙的电子式
(2)实验室可用下图所示装置制备并收集甲。
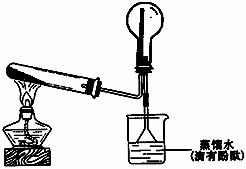
① 写出试管中发生的化学反应方程式 (2分)
② 烧杯中溶液由无色变为红色,其原因是(用化学反应方程式来表示)
(2分)。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com