
32.(14分)X、Y、Z三种化合物均由短周期元素组成。已知三种化合物的水溶液的焰色反应均呈黄色,Y和Z均由三种元素组成。请根据题目的要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键
(2)写出X与二氧化碳反应的化学方程式 。
(3)下表为Y和Z实验的部分内容
|
序号 |
主要实验步骤及实验现象 |
|
① |
在Y的无色溶液中,加入稀硫酸,放置。产生浅黄色沉淀和无色有刺激性气味的气体。该气体可使品红溶液褪色。 |
|
② |
在Z的无色溶液中,滴加的盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀。 |
|
③ |
将实验②最终得到的混合物加热蒸发、灼烧,最终得到固体。 |
写出含0.1 mol Z的溶液与20 mL 5mol/L的盐酸反应的离子方程式:
实验③加热蒸发、灼烧得到的最终产物主要是 和 。
(4)写出Y与稀硫酸反应的离子方程式 。
31.(16分)A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为___________________________________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为__________________________________________。
(3)经测定,A2C2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________________________________。过去常用硫酸处理BaO2来制备制备A2C2,写出该反应的离子方程式___________________________;
现在实验室可以将过氧化钠加入到水中来制取A2C2,写出该反应的化学方程式_______________________________________________________________;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到了上述目的,又保护了环境,试写出反应的离子方程式______________________________________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃。
① DA能与水反应放氢气,反应化学方程式是 。
②若将1mol DA和1 mol E单质混合加入足量的水,生成气体的体积是(标准状况下) L
30.(15分)某待测液可能有Fe2+、Fe3+、Ag+、Ba2+、Al3+、Ca2+、NH4+等离子,进行了下述实验(所加酸、碱、NH3水、Br2水都是过量的)。
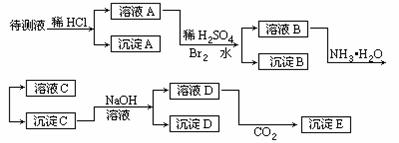
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由。答_________。
(2)写出化学式:沉淀A_________;沉淀D_________;沉淀E_________。
(3)写出下列离子反应方程式:
溴水氧化溶液A中的某离子:_________。
沉淀C加入足量NaOH溶液后其中一种沉淀溶解:_________。
20.设NA为阿伏加德罗常数的数值,则下列说法正确的是 ( )
A.在9.5g离子化合物NH5中,阳离子的电子数为5NA
B.在标准状况下,体积为22.4L的己烷完全燃烧后,所生成气态产物的分子数为6NA
C.16gO2在反应中做氧化剂时转移的电子个数一定是2NA
D.在标准状况下,46gNO2和N2O4混合物所含原子个数是3NA
第II卷 (共182分)
19.下列离子方程式中,正确的是 ( )
A.在氯化亚铁溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2Clˉ
B.三氯化铁溶液跟过量氨水反应:Fe3+ + 3NH3•H2O = Fe(OH)3↓ + 3NH4+
C.碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.钠与水的反应:2Na + 2H2O = 2Na+ + 2OH- + H2↑
12.将ag氯化钾溶于1.8L水中,恰好使k+离子数与水分子数之比为1:100,则a值为
( )
A.0.745 B.0.39 C.39 D.74.5
11.在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是 ( )
A.Na+、SO32-、SO42-、K+ B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO4-、NO3-、Na+ D.K+、Ca2+、SO32-、Cl-
10.已知常温下,在溶液中可发生如下反应:
Ce4+ + Fe2+ = Fe3+ + Ce3+, Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+
由此推断Fe2+ 、Ce3+、 Sn2+ 的还原性由强到弱的顺序是 ( )
A.Sn2+、Fe2+ 、Ce3+ B.Fe2+ 、Ce3+、 Sn2+
C.Fe2+ 、Sn2+ 、Ce3+ D.Ce3+、Fe2+ 、Sn2+
9.下列关于胶体的说法不正确的是 ( )
A.可用渗析法提纯胶体
B.胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小
C.胶体微粒不能透过滤纸
D.往25mL沸水中逐滴加入2mLFeCl3饱和溶液,继续煮沸可以制得Fe(OH)3胶体
8.同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的 ( )
A.质量 B.原子总数 C.碳原子数 D.密度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com