
9.实验室进行NaC1溶液蒸发时,一般有以下操作过程
①固定铁圈位置 ②放置酒精灯 ③放上石棉网 ④放上蒸发皿
⑤加热搅拌 ⑥停止加热、余热蒸干
其操作顺序为
A.①②③④⑤⑥ B.②①③④⑤⑥ C.②①④⑤⑥ D.②①③④⑤
8.高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是
A.制高铁酸钾用ClO-做还原剂
B.制备高铁酸钾时,1mol Fe(OH)3得到3mol电子
C.高铁酸钾中铁的化合价为+6 ,其氧化性强于ClO-的氧化性
D.用高铁酸钾处理水时,利用了其强氧化性,且其还原产物能水解产生具有强吸附能力的胶体
7.下列氧化还原反应中,水既不做氧化剂、又不做还原剂的是
A.CO+H2O CO2+H2
B.SO2+H2O
=H2SO3
CO2+H2
B.SO2+H2O
=H2SO3
C.2Na2O2+2H2O = 4NaOH+O2↑ D.2F2+2H2O = 4HF+O2
25.(8分)现在铁粉与Fe2O3组成的混合物共4.88g,将这些混合物投入到足量的稀H2SO4中,经充分反应后,在标准状况下共收集到0.448L气体,向所得溶液中加入100Ml0.1mol/LKMnO4才能将其中Fe2+完全氧化成Fe3+,计算原混合物中Fe2O3的质量。
24.(10分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物(注:铜离子和KSCN不发生反应)。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)若假设2成立,则实验现象是有 。
(3)若固体放入足量稀硫酸中,经充分反应后,固体全部溶解,滴加KSCN试剂时,溶液不变红色,则证明假设 (填数字)成立,写出可能发生的离子方程式 。
(4)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲用加热法测定CuO2的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中CuO2的质量分数为 。
23.(12分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物质杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
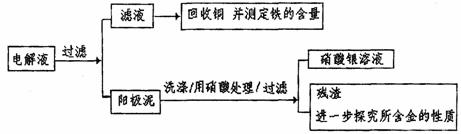
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:(注:可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应浓度系数次幂的连乘积成正比,这个比值叫做平衡常数。)
|
序号 |
反应 |
平衡常数 |
|
1 |
Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O |
<<1 |
|
2 |
Au3++4Cl-=AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: 。
(2)滤液含量的测定:
以下是该小级探究滤液的一个实验流程:
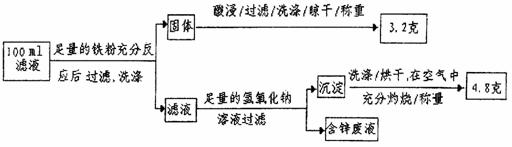
由100mL滤液中Cu2+的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1。
22.(12分)化工生产中用烷烃和氧气或水蒸气反应可得到以CO和H2为主的混合气体,这种混合气本可用于生产甲醇或合成氨。对甲烷而言,有以下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g);△H1=-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g);△H2=+216kJ·mol-1
(1)反应②中参加反应的CH4(g)与H2O(g)的总能量 (填“大于”、“小于”或“等于”)生成的CO(g)与H2(g)的总能量。
(2)若氧气和水蒸气的混合气本中氧气的物质的量分数为x,填写下列空白。
|
序号 |
x(O2) |
反应①的△H/(kJ·mol-1) |
反应②的△H/(kJ·mol-1) |
总反应的△H/(kJ·mol-1) |
|
I |
0.2 |
-18 |
|
|
|
II |
|
-36 |
|
+72 |
(3)若此化工厂生产中反应的能量在利用过程中不计损耗,为使能量实现零排放和零补充,则进料气中水蒸气与空气(O2的体积分数为20%)的体积之比为 。
21.(8分)某一反应体系中有反应物和生成物共6种:HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
(1)该反应的氧化剂是 。
(2)在该反应中,发生氧化反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
。
(4)SnCl4与SnCl2可用Hg2+来鉴别,HgCl2与SnCl2反应的产物是SnCl4和HgCl2(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为 。
20.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上。其晶体中的阴离子晶胞结构如图示,下列说法不正确的是 ( )
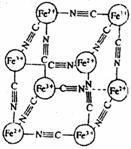
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为M1Fe2(CN)6,且M为+1价
第Ⅱ卷(选择题 共50分)
19.高铁酸钾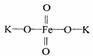 (K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要方程式为:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
干法制备的主要方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是 ( )
A.高铁酸钠中铁显+6价
B.干法中每生成1molNa2FeO4转移3mol电子
C.干法中每生成1molNa2FeO4转移4mol电子
D.K2FeO4处是水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的
Fe(OH)3还能吸附水中的悬浮杂质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com