
9.以下能大量共存的离子组是
A.无色溶液:Na+、Fe3+、NO3-、SO32-
B.能使pH试纸呈红色的溶液:K+、Al3+、Cl-、NO3-
C.含有0.1 mol·L-1 Al3+的溶液中:NH+4、Ca2+ 、NO3―、HCO―3
D.室温下,pH=1的溶液中:K+、Mg2+、I-、SiO32-
8.下列离子方程式与所述事实相符且正确的是
A.铁与稀HNO3反应:Fe + 2H+ = Fe2+ + H2↑
B.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C.氯气通入水中:Cl2 + H2O  H+ + Cl- + HClO
H+ + Cl- + HClO
D.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
7.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA
B.1 mol乙烷分子含有8 NA个共价键
C.1 L 1 mol/L的Na2SO3溶液中SO32-的数目为NA
D.100 mL 0.2 mol/L HF溶液中含有的H+数目为0.2NA
选择题(每小题只有一个选项符合题意)
6.酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列有关此测定原理正确的是
①乙醇在此反应中做还原剂 ②Cr3+在此反应中做氧化产物
③K2Cr2O7具有强氧化性 ④乙醇在此过程中得电子
A.②④ B.②③ C.①③ D.①④
29.(8分)将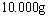 氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为
氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为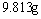 。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为
。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为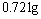 。求原混合物中各化合物质量。
。求原混合物中各化合物质量。
28.(18分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生水解促进反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是___________________。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到溶液最终变黄色,同时观察到的另一现象是____________________。将所得溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_______________________________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ、Ⅱ,产生的现象完全相同。由上述实验得出的结论是_________________________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是________________ 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
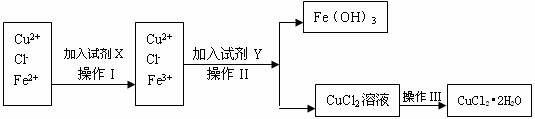
27.(12分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
请参照下表给出的数据填空。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Cu2+ Fe2+ Fe3+ |
4.7 7.0 1.9 |
6.7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示); 。
26.(12分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物。
①写出C和H2O反应生成E和D的化学方程式:
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
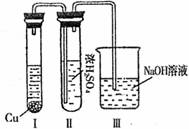
③已知常温下物质A与物质B生成1mol气体C的焓变为-57.07kJ,1 mol气体C 与H2O反应生成D溶液和E气体的焓变为-46kJ,写出物质A与物质B及水生成D溶液的热化学方程式: 。
25.实验室有一瓶久置的白色粉末,经元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比39:16,下列结论不正确的是 ( )
A.根据元素分析的结果推测该粉末有可能是纯净物
B.将粉末溶于水,加入氯化钡溶液,观察有白色的沉淀生成,证明原来的粉末是硫酸钾
C.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡产生,则原粉末可能是硫酸钾和亚硫酸钾的混合物
D.该粉末可能是硫化钾、硫酸钾和亚硫酸钾的混合物
Ⅱ卷(共50分)
该部分从第26题到第29题,请考生用钢笔将答案直接写在答题卡相关区域。
24.能正确表示下列反应的离子方程式是 ( )
A.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2-+4H+ Al3++2H2O
B.石灰水与足量碳酸氢钠溶液反应:HCO3-+Ca2++OH- CaCO3↓+H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- BaSO4↓+2H2O
D.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O Fe(OH)3↓+3H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com