
16.已知在硫酸铝、硫酸钾和明矾的混合溶液中,C(SO42-)=0.2mol/L,若向其中加入等体积0.2mol/L的KOH溶液(混合后体积变化忽略不计),恰好使所生成的沉淀完全溶解,则所得溶液中的C(K+)为( )
A.0.250mol/L B.0.225mol/L C.0.150mol/L D.0.450mol/L
第Ⅱ卷(非选择题 52分)
15.a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.①③ D.②④
14.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是( )
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
|
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为12e-
13.硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A.S2- B.S C.SO32- D.SO42-
12.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是( )
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
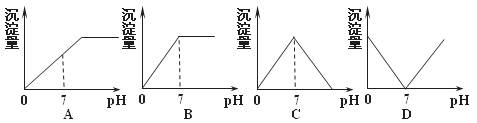
11.向盛有NaHSO4溶液的烧杯中不断滴Ba(OH)2溶液,随着Ba(OH)2溶液的不断滴入,溶液中产生的沉淀量与pH变化情况正确的是( )
10.下列离子方程式正确的是( )
A.NaHCO3溶液中加入足量Ca(OH)2溶液
2HCO3- +Ca2+ +2OH-→CaCO3↓+ CO32-+2H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液
2HCO3- +Ca2+ +2OH-→CaCO3↓+ CO32-+2H2O
C.等物质的量的Ba(H2PO4)2与NaOH溶液反应
Ba2+ +H2PO4-+OH-→ BaHPO4↓+ H2O
D.Na2CO3溶液中加入足量苯酚:CO32-+
2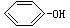 →2
→2 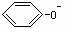 + CO2↑+ H2O
+ CO2↑+ H2O
9.向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )
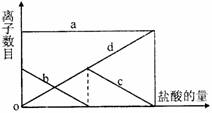
|
|
a |
b |
c |
d |
|
A |
Cl- |
K+ |
CO32- |
HCO3- |
|
B |
K+ |
CO32- |
Cl- |
HCO3- |
|
C |
K+ |
CO32- |
HCO3- |
Cl- |
|
D |
K+ |
HCO3- |
Cl- |
CO32- |
8.某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2 ②Cl2 ③CH4 ④HCl
⑤NH3 ⑥NO ⑦NO2 ⑧SO2,下列操作正确的是 ( )

A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
7. 有BaCl2和NaCl混合溶液aL,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗xmol稀硫酸,ymolAgNO3。据此得知原混合溶液中的钠离子物质的量浓度为( )
有BaCl2和NaCl混合溶液aL,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗xmol稀硫酸,ymolAgNO3。据此得知原混合溶液中的钠离子物质的量浓度为( )
 A.(y-2x)/a B.(y-x)/a
C.(2y-2x)/a D.(2y-4x)/a
A.(y-2x)/a B.(y-x)/a
C.(2y-2x)/a D.(2y-4x)/a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com