
2.分类方法在化学学科发展中起到了非常重要的作用。下列分类标准合理的是 ( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
1.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1mol
N-N吸收167kJ热量,生成1molN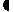 N放出942kJ热量根据以上信息和数据,下列说法正确的是 ( )
N放出942kJ热量根据以上信息和数据,下列说法正确的是 ( )

A.N4属于一种新型的化合物 B.N4式量比P4(白磷)高
C.N4与N2互为同素异形体 D.1molN4气体转变为N2将吸收882kJ热量
29.(15分)
(1)下列物质属于非电解质的是 ,属于弱电解质的是
①氨水 ②SO2 ③Cl2 ④甲酸 ⑤BaSO4 ⑥CH3CH2OH ⑦H2O ⑧NaHCO3
(2)将浓度均为2mol•L-1的AgNO3与Cu(NO2)2溶液各0.5L混合,以铜为电极进行电解一段时间之后,阴极上有1.6g铜析出.
回答下列问题:
①阴极上是否有银析出? (填“有”或“没有”),若有,析出银的质量为 g
②直流电源已输出 mol电子.
③溶液中Cu2+的物质的量浓度为 mol•L-1
28.(15分)实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体通入NaOH溶液过程中极易过量生成NaHCO3,且无明显现象.
实验室有下列试剂:①未知浓度的NaOH溶液;②37﹪的盐酸;③37﹪的硫酸;④14﹪的盐酸;⑤大理石;⑥K2CO3固体;⑦碱式碳酸铜.
实验室有以下仪器:铁架台,启普发生器,量筒,烧杯,橡皮管,玻璃导管,分液漏斗,已知下表中各物质在常温时的溶解度(g/100g•H2O)
|
Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
|
15.9 |
8.4 |
35 |
35.5 |
20 |
40 |
(1)实验应选用的仪器:除启普发生器,橡皮管,玻璃导管外,还需要: .
(2)为了保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号):除①外,还需要: .
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略)
(4)据实验给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在通入CO2过程中会有晶体析出(写出计算步骤和必要的文字说明)?
27.(15分)卤代烃R-Cl在一定条件下可发生如下反应:R-Cl+KCN→R-CN+KCl;
R-CN+2H2O+H+→R-COOH+NH4+ ,以乙烯为原料经过下图所示的反应可制取有机物w(A、B、C、D、E均为烃的衍生物)
(1)若甲为Cl2,乙为HCl,A和D两种物质的关系是
①同一物质 ② 同系物 ③ 同分异构体 ④ 以上都不对
(2)若甲为HCl,乙为Cl2,生成物W的分子式为C5H10O3,则W的结构简式为 。
(3)若甲为Cl2,乙为Br2 。按下列要求写出C+E→W的化学方程式:
①W为最小环状分子 。
②W为高分子 。
26.(15分)
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ•mol-1。请回答下列问题:
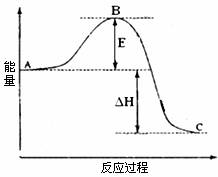
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响?
。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
,理由是 ;
(2)图中△H= KJ•mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol•L-1•min-1,则υ(O2)= mol•L-1•min-1
(5)已知单质硫的燃烧热为296 KJ•mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
13.以下实验事实中能证明无色透明液体是纯净水的是 ( )
A.测得该液体pH=7
B.电解该液体得到氢气和氧气,测其体积比为2:1
C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声
D.在l.01×l05Pa压强下测得沸点为373.15K
第Ⅱ卷 (非选择题)
12.下列反应的离子方程式正确的是 ( )
A.氢氧化钡与硫酸镁溶液反应 Ba2++SO2-4====BaSO4↓
B.碳酸氢钠溶液中加入过量石灰水:HCO-3+ OH-= CO32-+ H2O
C.用小苏打治疗胃酸过多: HCO-3+H+=CO2↑+H2O
D.向苯酚钠溶液中通入少量二氧化碳:CO2 + H2O + 2C6H2O- → 2C6H5OH + CO2-3
11.下列物质中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是( )
A.甲苯 B.乙醇 C.丙烯 D.乙烯
10.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L•S)
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com