
7.xR2+ + yH+ + O2 = mR3+ + nH2O的离子方程式中,对m和R3+的判断正确的( )
A.m=4, R3+是氧化产物 B.m=n, R3+是氧化产物
C.m=2, R3+是还原产物 D.m=2n, R3+是还原产物
6.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径小于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍跟冷水反应产生氢气
5.最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种物质的叙述中正确的是 ( )
A.是混合物 B.是化合物
C.不含极性键 D.其晶体是原子晶体
4.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )
A.硫酸生产中常采用高压条件提高SO2的转化率
B.合成氨中采用及时分离氨气以提高反应速率
C.铁上镀铜时,电解液中c(Cu2+)基本保持不变
D.铝热反应常用于冶炼某些熔点较低的金属
3.下列叙述一定正确的是 ( )
A.H2O、D2O、T2O互为同位素
B.pH=1的溶液中,K+、Na+、NO4-、S2O32-不能大量共存
C.元素周期表中从上至下同主族元素单质的熔.沸点依次升高
D.乙炔.氢气.铁分别与氯气反应,都会因用量或条件不同而生成不同产物
2.化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是 ( )
A.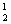 H
B.
H
B. 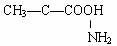
C.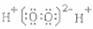 D.OHCCHO
D.OHCCHO
1.化学知识广泛应用于生产.生活中,下列叙述正确的是 ( )
A.空气中的臭氧对人体健康有益无害
B.液氯罐泄漏时,可将其移入水塘中并加入生石灰
C.由石英制取单晶硅的过程中,不涉及氧化还原反应
D.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
29.(14分)过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可以利用的资源,其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为:
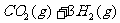
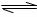
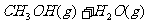
请填空:
(1)写出上述反应的平衡常数表达式K=______________________.
(2)在容积为2 L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如下图所示。下列说法正确的是(填序号)___________。
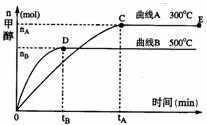
A.在300℃,从反应开始到平衡,甲醇的平均反应速率
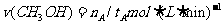
B.反应体系从300℃升温到500℃,平衡常数K变大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升温到500℃,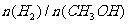 增大
增大
(3)25℃,1.01×10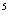 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________。
Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是__________________
正极的电极方程式为_________________________。
(5)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
28.(15分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g)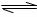 H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
|
t/min |
0 |
2 |
4 |
6 |
8 |
10 |
|
n(HI)/mol |
0.180 |
0.164 |
0.152 |
0.144 |
0.140 |
0.140 |
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为 。达平衡时,HI的转化率是_________。
(2)上述正向反应是: 反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g)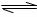 2HI(g)的平衡常数K的值为 。
2HI(g)的平衡常数K的值为 。
(5)要增大反应2HI(g)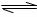 H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
A.增大HI起始浓度 B.向混合气体中通入I2
C.使用高效催化剂 D.升高温度
27.(17分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
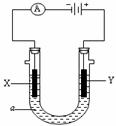
(1)若X、Y都是金属铁电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 。
总反应方程式是 。
(2)如要用电解方法在铁表面镀铜,电解液a选用 溶液,则:
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com