
6.下列关于能源和作为能源的物质叙述错误的是 ( )
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用是,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同的条件下转为热能、电能为人类利用
D.吸热反应没有利用价值
5.为了测其酸碱反应的中和热,计算时至少需要的数据是:①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后温度变化;⑦操作所需的时间 ( )
A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部
4.已知下列热化学方程式:Hg(l)+1/2O2(g)=HgO(s) △H =-90.7 kJ·mol-1
Zn(s)+1/2O2(g)=ZnO(s) △H =-351.1kJ·mol-1。
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为 ( )
A.-260.4 kJ·mol-1 B.-441.8 kJ·mol-1
C.260.4 kJ·mol-1 D.441.8 kJ·mol-1
3.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是 ( )
A.因该反应为放热反应,故不必加热就可以发生
B.M和N的总能量一定低于X和Y的总能量
C.X的能量一定高于M,Y的能量一定高于N
D.破坏反应物中的化学键所吸收的能量大于形成生成物中的化学键所放出的能量
2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。该现象说明了 ( )
A.该反应是吸热反应
B.铁粉和硫粉在常温下能自发反应
C.该反应是放热反应
D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量
1.下列说法中正确的是 ( )
A.非自发反应在任何条件下都不能实现
B.熵增加且放热的反应一定是自发反应
C.凡是放热反应都是自发的,吸热反应都是非自发的
D.自发反应一定是熵增大,非自发反应一定是熵减小或不变
27. 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
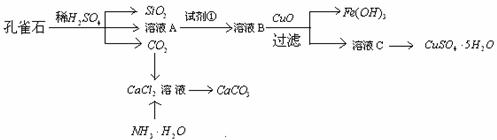
 请回答下列问题:
请回答下列问题:
 (1)写出碱式碳酸铜与稀硫酸反应的化学方程式
(1)写出碱式碳酸铜与稀硫酸反应的化学方程式
(2)简述氯化钙溶液中通入二氧化碳没有碳酸钙生成的原因 ;
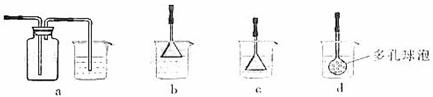
制备CaCO3时,应向CaCl2溶液中先通入氨气(氨气极易溶于水),若实验过程中有氨气逸出,应选用下列 装置收集(填代号)。
用方程式表示在氯化钙溶液中通入足量氨气,再通入二氧化碳,产生碳酸钙沉淀的过程________________________________________________________________
(3)在孔雀石中加入稀硫酸后,用 方法分离出溶液A;由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作,在这些操作中,除烧杯、漏斗外,还需的主要仪器有 。
26.(5分)根据Al、 Na、Mg分别与稀硫酸反应的化学方程式推断:
(1)若硫酸足量,等质量的Al 、Na、Mg产生H2的质量之比为_________________。
(2)若盐酸浓度相等,体积相等,投入的Al、 Na、Mg质量相等,反应后有一种金属剩余,该金属是________________。
25.(10分)实验室将3.675g氯酸钾和适量二氧化锰混合后加热制取氧气。请根据方程式列式计算,生成氯化钾的物质的量为多少?标准状况下能收集到多少体积的氧气?电子转移的物质的量为多少?
24.(共22分)实验室常用二氧化锰和浓盐酸制取氯气,工业上用电解饱和食盐水产生氯气。
(1)(5分)写出电解饱和食盐水的化学方程式,并在化学方程式中表示出电子转移的方向和数目: 。
若有56.0 L氢气(标准状况)生成,则理论上有 个电子发生转移。
(2)(5分)漂白粉是常用的消毒剂。工业上将氯气通入石灰乳中制取漂白粉的化学反应方程式为 ,漂白粉的有效成分是(填名称) 。漂白粉溶于水后,受空气中的CO2作用,漂白、杀菌作用增强,请用化学方程式解释原因 。
(3)(12分)实验室用二氧化锰制取氯气的反应的氧化剂是 。若制得标准状况下的Cl23.36L,参加反应的MnO2的物质的量 ,则有 g还原剂被氧化。
下图是在没有通风橱的条件下收集氯气时设计的一种装置图,图中A、B是可控制的弹簧铁夹。水槽中应盛放的液体是__________,烧杯中盛放的液体是_______,其作用是____________,有关反应方程式_______。
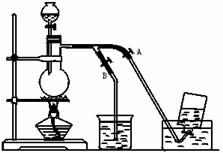
试分析下列操作如何控制A、B夹,①在氯气刚产生时,应______________,②当氯气纯度合乎要求要收集时,应_____________。③当氯气收集完毕时,应____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com