
9.北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。已知: ,
,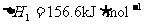 ;
;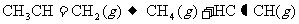 ,
,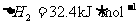 ;则相同条件下,反应
;则相同条件下,反应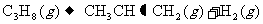 的△H为
的△H为
A.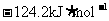 B.
B.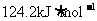
C.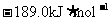 D.
D.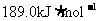
8.下列各组物质的无色溶液,不用其他试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 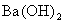 H2SO4
H2SO4
③HCl NaAlO2
NaHSO4 ④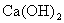 Na2CO3
BaCl2
Na2CO3
BaCl2
A.①②④ B.②③ C.①③④ D.①②
7.每个公民都应该有安全意识,频繁发生的有关化学品泄漏或爆炸事件一次又一次地给我们敲响了警钟。下列做法存在安全隐患的是
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;
②给试管中液体加热时,应将试管倾斜,与桌面成45°,集中在药品处加热;
③取用金属Na或K时,用剩的药品要放回原瓶;
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;
⑤在做苯酚性质实验时,因为常温时苯酚在水中溶解度较小,所以可以将废液直接通过水池排入下水道;
⑥废旧电池应回收处理。
A.①②④⑤ B.①④ C.①③⑤ D.全部
6.食品卫生与人类的身体健康密切相关,下列做法对人体无害的是
A.在奶粉中添加三聚氰胺可增加蛋白质的含量
B.用福尔马林(40%的甲醛)使鱼肉等食品长时间保鲜
C.在鸭饲料里添加工业染料“苏丹红”使鸭子生产红心鸭蛋
D.在食盐中加乳酸锌以防止儿童缺锌
24.(14分)已知反应:
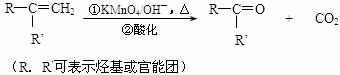
A可进行如下反应(方框内物质均为有机物,部分无机产物已略去)。
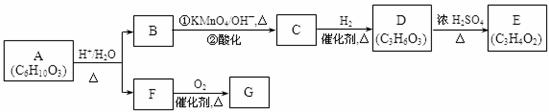
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是 ,名称是 。
(2)G与F的相对分子质量之差为4,则G具有的性质是 (填序号)
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G最多可与2 mol 新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,又知两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是:
,该反应类型是 反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
. 。
(5)A转化为B和F的化学方程式是:
23.(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为: NH3+CO2+H2O NH4HCO3
NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某课外活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持.固定用的仪器未画出)。
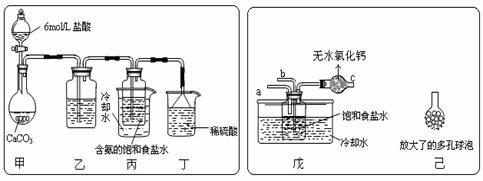
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ,该试剂的作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
;
(3)请你再设计出一种实验室制取少量碳酸氢钠的方法:(用文字简要说明)
。
22.(12分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。

(1)写出A在加热条件下与H2反应的化学方程式
____________________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”.“不变”或“减小”),理由是________________________________。
21.(10分)A、B、C、D、E是原子序数小于18的五种元素,且原子序数依次增大,其中A与B原子的最外层电子数相同,B、C、D、E位于同一周期,D原子的最外层电子数与电子层数相同,E- 与Ar原子的核外电子排布相同。
(1)E显+1价含氧酸的化学式为 。
(2)B的最高价氧化物的水化物与D的最高价氧化物的水化物相互反应的化学方程式为 。
(3)在常温下,D与E形成的化合物的水溶液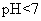 ,原因是
(用离子方程式表示)。
,原因是
(用离子方程式表示)。
(4)常温常压下, 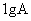 的单质在E的单质中完全燃烧,生成共价化合物,并放出
的单质在E的单质中完全燃烧,生成共价化合物,并放出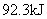 的热量,该反应的热化学方程式为
。
的热量,该反应的热化学方程式为
。
(5)将C与E组成的化合物溶于水配成溶液,用惰性电极进行电解,阴极的还原产物与阳极的氧化产物的物质的量之比为 。
20.pH=1的两种一元酸HX与HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2体积分别为V(HX)和V(HY)。若V(HX)>V(HY),则下列说法正确的是 ( )
A.HX可能是强酸
B.HX的酸性比HY的酸性弱
C.两酸的浓度大小c(HX)<c(HY)
D.将两种一元酸均稀释100倍,稀释后两溶液的pH均为3
第二卷:非选择题(共60分)
19.下列实验问题处理方法错误的是 ( )
① 用pH试纸测溶液pH时,将试纸用水润湿再蘸取待测液
② 实验中,点燃CO前应首先检验CO的纯度
③ 实验结束后,可将所有的废液倒入下水道排出实验室
④ 给试管中的液体加热时加入碎瓷片,以免暴沸伤人
⑤ 测定硫酸铜结晶水含量时,将晶体加热至白色,然后冷却.称重即可计算
⑥ 配制稀硫酸时,先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A.①② B. ②④⑤ C.①③⑤ D.②④⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com