
4.对下列各种溶液中所含离子的判断合理的是 ( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-,Br-,OH-,Ba2+
B.在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO2-,CO32-,SO32-
C.某溶液加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3-
3.下列物质的分类正确的是 ( )
|
A |
B |
C |
D |
|
淀粉-混合物 |
苯酚-有机物 |
液氯-非电解质 |
胆矾-分子晶体 |
|
明矾-纯净物 |
纯碱-盐 |
碳酸钙-强电解质 |
食盐晶体-离子晶体 |
|
盐酸-化合物 |
氧化铝-两性氧化物 |
醋酸-弱电解质 |
金刚石-原子晶体 |
2.下列说法中正确的是 ( )
A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热
B.铝粉与氧化铁粉末反应中生成物总能量高于反应物总能量
C.H2S的热稳定性小于H2O是由于H2S分子间不存在氢键
D.原子晶体中的各相邻原子间都以共价键相结合
1.下列有关化学用语正确的是 ( )
A.CO2分子的比例模型:
B.质量数为37的氯原子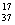 Cl
Cl
C.NH4Cl电子式: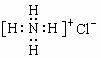
D.Cl-原子的结构示意图: 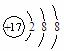
21.(8分)有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、Cl-、CO32- 等离子,现分别取3份等体积溶液进行下列实验:
第一份:加入AgNO3溶液,有黄色沉淀 生成;
生成;
第二份:加入淀粉,未见蓝色;
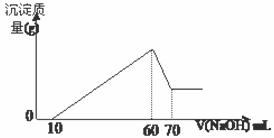
第三份:在逐滴加入1mol·L-1 NaOH溶液的
过程中,未闻到刺激性气体,随NaOH溶液的滴入,
产生沉淀的量如图所示,试回答:
(1)溶液中一定存在的离子有 ;
(2)其中阳离子物质的量分别为 。
20.(8分)工业生产金属铝的原料是某铝土矿(主要成分为Al2O3,另含有Fe2O3和CaCO3等),工业得到较纯氧化铝的过程如下图所示:
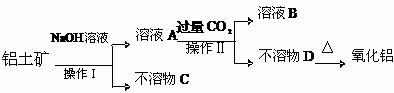
试回答下列问题:
(1)操作Ⅰ是一种重要的混合物分离方法,实验室进行该项操作用到的玻璃仪器有烧杯、
、 ;
(2)不溶物D的化学式为 ;
(3)为了提高综合经济效益,实际工业生产中常将上述提纯氧化铝的相关物质循环利用。其部分转化关系如下图所示:
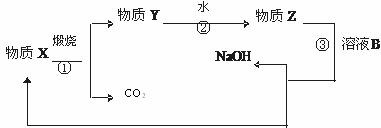
①被循环利用的物质是 (写化学式);
②写出转化③的化学方程式 。
19.(7分)把海水淡化和海洋化工结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得到淡水的方法,由此可判断蒸馏法属 (填物理变化、化学变化)
(2)2007年青岛市黄岛电厂在全国首先采用了国际上最先进的海水脱硫技术对电厂尾气进行处理。这一技术的基本原理是:利用海水显弱碱性的特点,将含二氧化硫的尾气与海水、空气充分混和,最终使二氧化硫转换为硫酸盐并且不污染海水。流程图如下:

若海水I中主要阴离子为HCO3-,则反应①的离子方程式为 ;反应②的离子方程式为 ;检验海水Ⅲ中是否含有SO32- 所用的试剂为 。
18.(6分)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感疫情,防控专家表示,含氯消毒剂和过氧化物消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3 和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是 ;
A.MnO2 B.KMnO4 溶液 C.稀盐酸 D.Na2SO3 溶液
(2)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3 在H2SO4存在下与Na2SO3 反应制得。请写出反应的离子方程式(不必配平): ;
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2 发生分解反应时,转移的电子个数是 。
17.(10分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
X |
最外层电子数是次外层电子数的3倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是 ,元素Z的离子结构示意图为 。
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论 。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: 。
(4)元素X与元素Y相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.Y的氢化物可在纯X2 中燃烧生成X的氢化物和Y2
b. X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态
16.(11分)某化学小组欲探究铁的化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴 管外,你认为本实验必不可缺少的一种玻璃仪器是
。
管外,你认为本实验必不可缺少的一种玻璃仪器是
。
(2)完成下列表格:
可选用试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实 验结论 验结论 |
|
① |
在FeCl2 溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
|
Fe2+具有 还原性 |
|
② |
在FeCl2
溶液中加入锌片 |
|
Zn+Fe2+=Zn2++Fe |
|
|
③ |
|
固体溶解,溶液由棕黄色变为蓝绿色 |
|
|
(3)根据以上实验结果判断,下列物质中既有氧化性,又有还原性的有: 。
(填序号)
A.Cl2 B.Na C.Cl- D.NO2
(4)亚铁盐在溶液中易被氧化,实验室中保存亚铁盐溶液时应该 以防止亚铁盐被氧化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com