
2、函数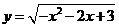 的递减区间为___________。
的递减区间为___________。
1、若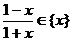 ,则
,则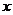 =____________________。
=____________________。
22.(10分)氢是重要而清洁的能源。要利用氢气作能源,必须能安全有效的把它储存起来,目前利用金属或合金来储存氢气已获得很大进展。镧La和镍Ni的一种合金就是储氢材料,该合金的一个晶胞如图,属于六方晶胞。该晶胞中的镍原子除一个在中心外,其他都在面上。
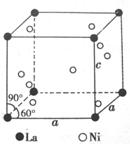
(1)写出该合金的化学式 。
(2)该合金晶胞的边长a=511pm、c=397pm以及各边之间的夹角如图所示,计算该合金的密度。
(3)若该合金每个晶胞能吸收3分子氢,吸收氢后晶胞的体积不变,计算该合金吸氢后的密度。
(4)已知液态氢气的密度约为78kg/m3,你认为所吸收的氢与金属之间的结合力比氢分子的结合力强还是弱? 为什么?(已知Ni与La的相对原子质量分别为58.69、138.9)
21.(8分)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
(1)P在元素周期表中的位置是 ,PH3的电子式为 ;
(2)上述反应体系中化学反应方程式为 _________ ,氧化产物是 ;
(3)膦(PH3)在水中的溶解度远小于氨的原因是
_______________________________________________。
20.(10分)SO42-和S2O82-(过二硫酸根离子)结构中,硫原子均位于由氧原子组成四面体的中心,且所有原子的最外层电子均满足8电子结构。已知S2O82-中两个硫原子间存在过氧键,S2O82-有强氧化性。H2S2O8能分步水解产生过氧化氢。
(1)请在下面方框中画出SO42-的立体结构图,分别用实
 心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置。
心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置。
(2)写出过二硫酸的结构简式,并确定氧、硫元素的化合
价______________________________。
(3)分析S2O82-有强氧化性的原因是_______________。
(4)写出H2S2O8在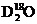 中水解的两步反应的化学方程式。
中水解的两步反应的化学方程式。
 第一步:______________________________________。第二步:______________________________________。
第一步:______________________________________。第二步:______________________________________。
19.(10分)随着纳米技术的飞速发展,四氧化三铁纳米颗粒在磁性记录、磁流体、吸波、催化、医药等领域有着广泛的应用。“共沉淀法”是制备四氧化三铁纳米颗粒的常见方法,具体步骤为:将一定量的FeCl2·4H2O和FeCl3·6H2O制成混合溶液加入到烧瓶中,在N2气氛下,滴加氨水、搅拌、水浴恒温至混合液由橙红色逐渐变成黑色,继续搅拌15 min,磁铁分离磁性颗粒,用蒸馏水洗去表面残留的电解质,60℃真空干燥并研磨,可得直径约10 nm Fe3O4磁性颗粒。
(1)“共沉淀法”中N2的作用是___________,制备的总离子反应方程式为________。
 (2)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如右图所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______,其中有______%正四面体空隙填有Fe3+,有________%正八面体空隙没有被填充。
(2)科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如右图所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______,其中有______%正四面体空隙填有Fe3+,有________%正八面体空隙没有被填充。
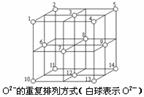
18.(10分)(1)一种Al-Fe合金的立体晶胞如图1所示。确定该合金的化学式____________。用NA表示阿伏加德罗常数,则晶胞质量的计算式是_________________,若晶胞的边长=a nm,则此合金密度的计算式是________________g/cm3。
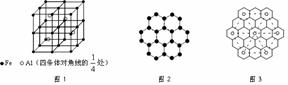
(2)石墨的层状结构如下图2所示,图中7个六元环实际占有的碳原子数是 ,若该层状结构可由很多个平行四边形无隙并置得到,每个平行四边形实际占有2个碳原子,请在图中画出一个这样的平行四边形。
 (3)石墨能与熔融金属钾作用,形成蓝色的C24K、灰色的C48K、C60K等。有一种青铜色的CxK中K原子(用o表示)的分布如图3所示,则x= ;另有一种石墨化合物C32K,其中K原子的分布也类似图的正六边形,该正六边形的边长是上右图中正六边形边长的
(3)石墨能与熔融金属钾作用,形成蓝色的C24K、灰色的C48K、C60K等。有一种青铜色的CxK中K原子(用o表示)的分布如图3所示,则x= ;另有一种石墨化合物C32K,其中K原子的分布也类似图的正六边形,该正六边形的边长是上右图中正六边形边长的
倍。
17.(8分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙为双原子分子,丙为负二价双原子离子,丁为原子,丙、丁所含元素位于同主族且单质都是原子晶体。
(1)丁的电子排布式是______________________;
(2)丙的电子式是_________________;
(3)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:_______________________。
(4)甲分子中含有________个σ键和_________个π键。
(5)丁的氧化物晶体中,丁原子发生_________杂化,氧原子发生_________杂化。
16.(10分)已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:____________、___________、_______________、_______________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是________元素或 _______元素(写元素符号)。
(3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:____________、____________、____________、____________、____________、____________。
15.(6分)2004年7月,法俄两国科学家共同宣布,在高压下,氮气会聚合生成高聚氮。在高聚氮晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N-N的键能为160kJ/mol,而氮气中N≡N的键能为942kJ/mol。则:
(1)高聚氮晶体属于 晶体。
(2)高聚氮转化为氮气时,将 (“吸收”或“放出”)能量,当生成1mol N2时,能量变化是 kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com