
30、(1)H+ + OH- = H2O,CO32- + H+ = HCO3- (各1分)
(2)224mL(2分)(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
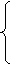 x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
84g/mol·x + 106g/mol·y + 40g/mol·z = 2.5g
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为0.6g,(1分)Na2CO3的质量分数为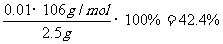
30、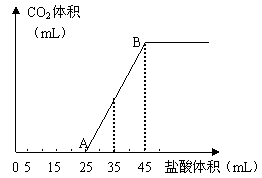 (奉贤一)(6分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(奉贤一)(6分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
___________________________________________
______________________________________ 。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
30.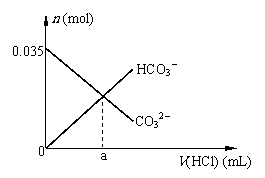 (浦东一)用1.00mol/L的盐酸滴定20.00mL
1.75mol/L的Na2CO3溶液(以甲基橙作指示剂),溶液中CO32-、HCO3-的量随盐酸体积的变化如图所示(不考虑盐类的水解):(每小题均需计算过程)
(浦东一)用1.00mol/L的盐酸滴定20.00mL
1.75mol/L的Na2CO3溶液(以甲基橙作指示剂),溶液中CO32-、HCO3-的量随盐酸体积的变化如图所示(不考虑盐类的水解):(每小题均需计算过程)
(1)a= mL
(2)当滴入盐酸20.00mL时,溶液中c(CO32-):c(HCO3-)=
(3)当滴入盐酸80.00mL时,溶液的pH= 。(溶液体积变化忽略不计,不考虑CO2的溶解)
30.(1) 20 (2分) (2)112 (2分) (3)120(2分)
30.(1)25.2%(2分)(2)0.1mol 0.2mol(2分)(3)175mL(2分)
30(金山二).用0.5 mol·L-1的盐酸滴定20 mL 1.0 mol·L-1的Na2CO3溶液。
(1)当溶液中n(HCO3-) = n(CO32-)时,用去盐酸______mL
(2)当滴入50 mL盐酸,反应后能收集到CO2的体积(标准状况)为______mL
(3)当滴入x mL盐酸并将溶液稀释到200 mL,反应完全后溶液的pH = 1,则x = ____
30.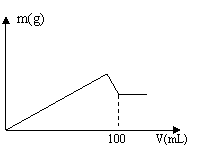 (卢湾二)有AlCl3和MgCl2的固体混合物,取一定量的该混合物加水溶解配成溶液,实验测知Cl-的物质的量为0.70摩尔,如向该混合溶液中逐滴加入8.00mol/L的氢氧化钠溶液(密度为1.27g/mL),加入氢氧化钠溶液的体积(V)和沉淀的质量(m)有右图所示的关系。
(卢湾二)有AlCl3和MgCl2的固体混合物,取一定量的该混合物加水溶解配成溶液,实验测知Cl-的物质的量为0.70摩尔,如向该混合溶液中逐滴加入8.00mol/L的氢氧化钠溶液(密度为1.27g/mL),加入氢氧化钠溶液的体积(V)和沉淀的质量(m)有右图所示的关系。
求:(1)原NaOH溶液的质量分数为 。
(2)AlCl3和MgCl2的物质的量分别是多少?
(3)另取64.70克该混合物溶于水,要使沉淀质量最大,需要加入8.00mol/L的氢氧化钠溶液多少毫升?
31.(虹口一)现有一种铜粉与氧化铜粉末的混合物。
(1)经测定该混合物中铜元素与氧元素的质量之比为6:1,则混合物中铜粉与氧化铜的物质的量之
比为多少?112g上述混合物在加热条件下与足量的浓硫酸充分反应后,产生S02的物质的量为多
少?
(2)若铜粉与氧化铜粉末的混合物中氧元素的质量分数为0.1,则l60g该混合物在加热条件下与足
量的浓硫酸反应,消耗硫酸的物质的量为多少?
(3)设混合粉末中氧元素的质量分数为x,160g该混合物与足量的浓硫酸反应,消耗硫酸的物质的量
为ymol,写出X的取值范围,及Y与X的函数关系。
30.(虹口一)含铝90%的铝合金1.5g与40mL6mol/L盐酸充分反应,合金中其它成分不反应。过滤除去不溶物,并将滤液稀释到200mL,取出稀释液l0mL,加入0.3mol/L的氨水使Al3+完全沉淀。(1)铝和盐酸反应生成的氢气有多少L(标准状况)?(2)使Al3+完全沉淀所需的氨水要多少mL?

26.(青浦一)将铝片(不除氧化膜)投入到浓氯化铜溶液中。铝表面很快出现一层海绵状暗红色物质,接下来铝片上又产生大量的气泡,触摸容器壁知溶液温度迅速升高,收集气体,实验具有可燃性。若用同样的铝片投入到同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴.铝与氯化铜溶液迅速反应,而与同浓度的硫酸铜溶液在短时间内不发生反应的原因是
A.氯化铜溶液的酸性比同浓度的硫酸铜溶液强 B.硫酸铜溶液水解产生的硫酸使铝钝化
C.氯离子能破坏氧化铝薄膜而硫酸根离子不能
D.生成的氯化铝能溶于水,而生成的硫酸铝不溶于水
⑵.铝片表面出现的暗红色物质是 ,产生该物质的离子方程式是
⑶.放出的气体是 ,请从有关物质的浓度、能量、是否电化学作用等分析产生气体的速度不断加快的原因
⑷.某同学通过一定实验操作,使铝片与硫酸铜溶液的反应也能较快进行,他采取的措施可能是
A.用砂纸擦去铝表面的氧化膜后投入到硫酸铜溶液中
B.把铝放在氢氧化钠溶液中加热一段时间后,取出洗净后投入到硫酸铜溶液中
C.向硫酸铜溶液中加入少量氢氧化钠溶液后,再投入铝片
D.在铝片上捆上几枚铜钉后投入等浓度的硫酸铜溶液中
⑸.把同样大小、同样质地的除去氧化膜的铝片分别投入同浓度的硝酸铜和硫酸铜溶液中,生成铜的速率
a.相同 b.在硝酸铜溶液中快 c.在硫酸铜溶液中快
简述原因是 。
26(12分)
⑴ C ⑵ Cu 3Cn + 2Al → 3Cu2+ + 2Al3+
⑶ H2 随着反应的进行,氯离子浓度增大,水解而使氢离子浓度增大,反应速率加快;反应放热,温度升高,加快速率;生成铜,形成原电池,加快反应速率。
⑷ A、B ⑸ c 硝酸铜溶液能溶解铜单质
26.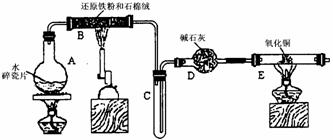 (静安一)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
(静安一)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
(1)仪器B的名称是___________,石棉绒的作用是_______________________________。
(2)B中发生反应的化学方程式是__________________________________________________。
(3)加热E以前要对装置中的气体验纯,方法是:收集一试管气体,然后____________________
________________________________________________________________。
(4)已知有反应:Cu2O+2H+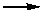 Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(5)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成或铜的相对原子质量。若反应前盛有药品的E、F的质量分别是bg、cg,反应后分别是dg、eg。
①水中元素的物质的量之比可表示为n(H):n(O)= _______________;若反应后E中除Cu外还含有另种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
②若空的E管的质量为ag,加热后CuO完全还原为Cu,则铜的相对原子质量可表示为______________________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com