
6、(闸北一)下列说法中,正确的是
A.铜锌原电池中,锌作阳极,铜作阴极
B.石墨电极电解氯化铜溶液的反应中,阳极上质量增重
C.铜锌原电池中,电子由锌极经导线流向铜极
D.石墨电极电解氯化钠溶液的反应中,在阳极得到氯气,在阴极得到金属钠
12. (卢湾一)如右图所示,a、b是两根石墨棒。下列叙述正确的是( )。
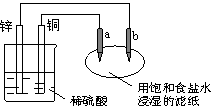 A.a是正极,发生氧化反应
A.a是正极,发生氧化反应
B.锌是阴极,发生的电极反应为:Zn-2e-→Zn2+
C.稀硫酸中溶液的pH变小
D.往滤纸上滴加酚酞试液,b极附近颜色变红
12.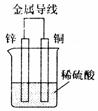 (闵行一)如图所示,下列叙述正确的是
(闵行一)如图所示,下列叙述正确的是
A.过程中溶液的PH会减小
B.锌为正极,发生氧化反应
C.铜棒上反应为2H++2e→H2↑
D.电流方向从Zn经导线到Cu
15. 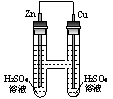 (普陀一)有关右图装置,描述正确的是
(普陀一)有关右图装置,描述正确的是
A. 电流从锌电极经金属导线流向铜电极
B. 锌为阴极,铜为阳极
C. 负极的电极反应式为:Zn – 2e→Zn2+
D. 一段时间后,溶液中阳离子浓度增大、阴离子浓度不变
21.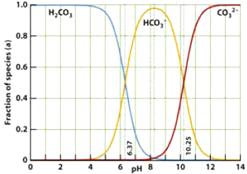 (黄浦二)右下图是一水溶液在pH从0至14的范围内,H2CO3、HCO
(黄浦二)右下图是一水溶液在pH从0至14的范围内,H2CO3、HCO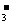 、CO
、CO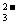 三种成分平衡时的各组分分数,下列叙述正确的是( )
三种成分平衡时的各组分分数,下列叙述正确的是( )
A.pH=2时,H2CO3、HCO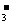 、CO
、CO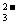 共存
共存
B.在pH为6.37及10.25时,溶液中
c(H2CO3)=
c(HCO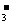 )= c(CO
)= c(CO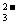 )
)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO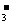 的形式存在
的形式存在
D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上
20、(闸北二)已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
根据上述电离常数分析,下列错误的是( )
A.25℃时,等物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)>pH(NaHCO3)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中
c(Na+)=c(CN-),则a一定大于b
C.2NaCN + H2O + CO2 →2HCN + Na2CO3
D.2CH3COOH+ Na2CO3 → 2 CH3COONa + H2O + CO2 ↑
17、(闸北二)常温下,0.1 mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.该溶液中水电离出的c(H+)=1×10-10 mol/L
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol/L
C.该溶液与0.05 mol/L NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
20.(松江二)常温下,现有a mol/LNaX溶液和b mol/LNaY溶液,关于它们的说法错误的是( )
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时HX、HY的酸性:HX>HY
B.若a=b,并测得c(X-)=c(Y-) + c(HY),如果HX是强酸,则HY一定是弱酸
C.若a>b,且上述两溶液呈碱性,c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY)
D.若两溶液等体积混合,测得c(X-) + c(Y-) + c(HX) + c(HY)=0.1mol/L,则可推出a=b=0.1 mol/L
19.(南汇二)将0.2mol/LNaA溶液和0.1mol/L盐酸等体积混合后,溶液pH>7,则以下关系式错误的是( )
|
B.c(A-)>c(HA)
C.c(Na+)+c(H+)=c(A-)+c(C1-)+c(OH-)
D.c(Na+)=c(A-)+c(HA)
15. (南汇二) 下列各选项中所述的两个量,前者一定大于后者的是( )
A. 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
B. pH=10的NaOH和Na2CO3溶液中,水的电离程度
C. 物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH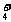 的物质的量浓度
的物质的量浓度
D. 相同温度下,10mL 0.1mol/L的醋酸与100mL 0.01mol/L的醋酸中H+的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com