
30.(静安一)2008年奥运会金牌背面镶嵌着白玉,白玉的化学式可用CaxMgySipO22(0H)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为____________g/mo1。
(2)另取4.05g白玉粉末加入lmol/L的盐酸l00mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则
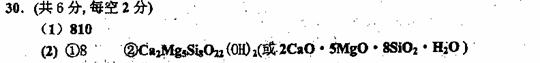 ①p=_______;②白玉的化学式为______________________________。
①p=_______;②白玉的化学式为______________________________。
30、(1)5 mol·L- 1 (2分) (2)33.6L (2分) (3)7:2(2分)
30.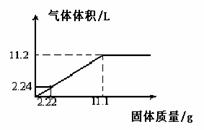 (南汇一)将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下 )与加入粉末的质量关系如下图所示:
(南汇一)将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下 )与加入粉末的质量关系如下图所示:
(1)硫酸物质的量浓度是 mol·L- 1 。
(2)当硫酸溶液为350mL ,固体粉末为33.3g时,充分反应后产生的气体体积为 L(S.T.P)
(3)原固体混合物中Mg和Al的物质的量之比为 。
12.3gMgSO4·xH2O中m(MgSO4)= (72-48) ×25%=6 (g); m(H2O)=6.3(g)
1/x=(6/120)/(6.3/18) x=7
30、(1)3.36L (2分) v(H2)=0.1×1.5×22.4=3.36 (L)
(2)25.0% (2分) C%=0.1×1.5×120/72=25%(3)7 (2分)
30、(闸北一)进行下列实验:将过量Mg粉溶于100 mL1.5 mol/L稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下恒温蒸发,当滤液质量为72.0g时开始析出MgSO4·xH2O晶体,当析出晶体12.3g时,剩下滤液48.0g。通过计算请回答下列问题(请写出计算过程)。
(1)生成标准状况下的气体体积;
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数;
(3)MgSO4·xH2O中的x值。
31.(1)0.1 mol(2分)(2)5.4 g (2分) 9.6 g (3分)(3)2.688 L(3分)
31.(卢湾一)(10分)现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL 2.0 mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140 mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。计算:
(1)实验①中用去NaOH的物质的量为 ;
(2)这包铝热剂中铝的质量为 ,氧化铁的质量为 ;
(3)实验②产生氢气的体积(标准状况)为 。
30.(6分)(1)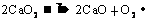 或
或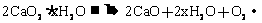 (2分)
(2分)
(2)65.5%(2分)(3)2 (2分)
30.(闵行二)过氧化钙(CaO2)是一种安全无毒的氧化物,常用作医用制氧剂。其组成中通常带有一定数量的结晶水并因变质含有少量CaO。为分析某过氧化钙样品的组成,进行了如下实验。
①称取3.30 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为336mL。
②另取1.65 g样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.200mol/LKMnO4溶液滴定,共用去31.0 mLKMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4→K2SO4+2MnSO4+5CaSO4+10CO2 +8H2O
(1)写出CaO2受热分解的化学方程式。 (2)计算样品中的CaO2的质量分数。
(3)计算样品中的CaO2•xH2O的x值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com