
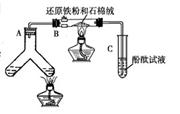
26.(卢湾二)如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。
 某课外活动小组通过查阅资料和多次实验,得到了如下信息:
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一: NaNO2固体和饱和NH4Cl溶液混合
加热的过程中发生如下反应:
①NaNO2+NH4Cl→NH4NO2+NaCl ② NH4NO2→NH3+HNO2
③ 2HNO2→N2O3+H2O ④2NH3+ N2O3→2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2 混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
|
N2和H2的体积比 |
5:1 |
3:1 |
1:1 |
1:3 |
1:5 |
|
酚酞变红色所需时间/min |
8~9 |
7~8 |
6~7 |
3~4 |
9~10 |
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式: 。
(2)铁粉撒在石棉绒上的目的是 。
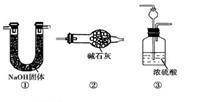
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是 ,请你另设计一个简单的实验验证你的理由 。欲解决这一问题,可以选用下图中的 装置连接在原装置中的 和 之间。
 (4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为 比较适宜;但该装置还难以实现此目的,原因是 。
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为 比较适宜;但该装置还难以实现此目的,原因是 。
(5)实验过程中通入试管C中的气体成分有 。
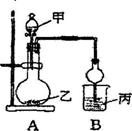
26.(虹口一)如下图所示实验装置进行实验(实验6、7、8是在加热时进行)。
|
实验 |
试剂甲 |
试剂乙 |
试剂丙 |
B中现象 |
|
1 |
H2O2 |
|
FeCl2 |
溶液由浅绿色变为棕黄色 |
|
2 |
浓氨水 |
CaO |
AgNO3 |
|
|
3 |
H2SO4 |
FeS |
Br2水 |
|
|
4 |
H2SO4 |
Na2SO3 |
BaCl2 |
|
|
5 |
|
CaCO3 |
氨化NaCI(饱) |
出现白色浑浊 |
|
6 |
浓H2SO4 |
NaCl |
含0.1molNaAlO2 |
白色浑浊、浑浊消失 |
|
7 |
浓HCl |
MnO2 |
FeI2 |
|
|
8 |
浓HNO3 |
Cu |
NaHCO3 |
|
 请回答:
请回答:
(1)实验l中试剂乙的化学式是 。
(2)实验2中B中溶液先出现 ,后 。
(3)实验3中B中反应的化学方程式为 。
(4)若要使实验4中的8装置内有白色沉淀生成,可向B中通入 。
a.NH3 b.NO2 c.HCl d.H2S
(5)实验5中的试剂甲使用错误的是 。B中的白色浑浊物是 。
a.稀HCl b.稀H2SO4 c.稀HNO3
(6)实验6中NaCl固体的质量至少为 克。
(7)实验7中B溶液中先参加反应的离子为 (写离子符号)。
(8)实验8中烧瓶内的现象是 。

26.(黄浦二)下图中A、B、C分别是某课外活动小组设计的制取氨气并进行喷泉实验的三组装置示意图,制取NH3选用试剂如图所示,回答下列问题:
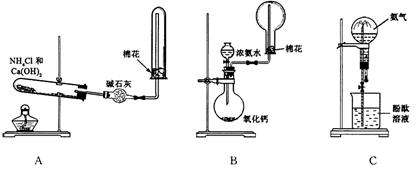
(1)用A图所示的装置可制备干燥的NH3
①反应的化学方程式为:________________________________________。装置中收集NH3的试管口放置棉花团的作用是_________________________________________。
②干燥管中干燥剂能否改用无水CaCl2___________,理由是_________________________。
(2)用B图所示的装置可快速制取较大量NH3拟作喷泉实验。
根据B图所示的装置及试剂回答下列问题:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:
________________________________________________________________________
②检验NH3是否收集满的实验方法是:______________________________________________。
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________________________,该实验的原理是:_______________________________。
若测得C装置烧瓶中NH3的质量是相同状况下相同体积H2质量的10倍,则喷泉实验完毕后,烧瓶中水可上升至烧瓶容积的___________(填“几分之几”)。
(1) ①2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O ,防止空气对流,使NH3充满试管 (1分)
CaCl2+2NH3↑+2H2O ,防止空气对流,使NH3充满试管 (1分)
②不能(1分);CaCl2+8NH3→CaCl2·8NH3 (1分,文字表达亦可)
(2)①CaO+H2O→Ca(OH)2 (1分),反应放热NH3·H2O NH3↑+H2O
(1分)
NH3↑+H2O
(1分)
②用玻璃棒蘸取少许浓盐酸靠近收集NH3的试管口,(1分)若产生白烟,说明试管已收集满NH3,反之,则没有收集满 (1分) 或用湿润的红色石蕊试纸靠近收集NH3的试管口,(1分)若湿润的红色石蕊试纸变蓝,则说明NH3已收集满,反之,则没有收集满 。(1分)
(3)打开止水夹挤出胶头滴管中的水;(1分)NH3极易溶解于水,致使烧瓶内压强迅速减小; 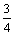
27、⑴ H2(2分),随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2(2分)。
(2) ① 检查装置气密性 (2分)。 ② 浓H2SO4,(1分) 干燥氢气(1分)
③ 黑色粉末变红色(1分), 无水硫酸铜变蓝色(1分) (3) 无法计算 (2分)
27.(普陀一)为了完成一项研究项目,需要22.4 L(S.P.T.)SO2。化学小组同学依据化学方程式:
Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
取65.0 g锌粒与98%的浓H2SO4 110mL (ρ=1.84 g/cm3)充分反应,锌粒全部溶解后,收集所得气体(X),经检验存在严重质量问题。
(1) 推测:化学小组制得的气体中可能混有的杂质气体主要是 (填分子式);产生杂质的主要原因是: 。
(2) 实验验证:化学小组的同学设计了如图装置,对退回的气体(X)取样进行认真探究(假设气体均能被完全吸收)。
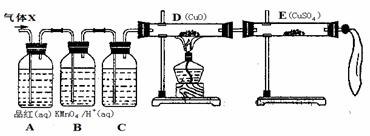
① 连接好装置后,必要的一个操作是 。
② C中加入的试剂是: ,作用为: 。
③ 证实气体x中混有主要杂质气体的实验现象是:
D中: ,E中: 。
(3) 结果处理:通入一定量的X气体,使B装置中酸性KMnO4溶液(200mL、0.20mol/L)恰好褪色;D装置实验前后质量变化1.6g。则X气体中SO2的体积分数 。
26. (1)①(2分)Cu + 2H2SO4 CuSO4 + SO2↑+2H2O
2Cu + O2 +2H2SO4→2CuSO4 + 2H2O
(1)①(2分)Cu + 2H2SO4 CuSO4 + SO2↑+2H2O
2Cu + O2 +2H2SO4→2CuSO4 + 2H2O
②B装置中的导管长进短出,如右图③(2分)Na2SO3 、Na2SO4 、NaOH(2)ABC
(3)①通入O2前,用排饱和NaHSO3溶液的方法装置A产生的气体体积(或通入O2前,将A中的铜片取出,洗涤、烘干,称量剩余铜片的质量,根据铜片的质量求出SO2的量)②否 用酚酞作指示剂时,溶液中的Cu2+会与NaOH反应,使得测定结果不准确。
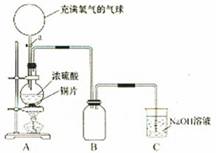
26.(嘉定一)某课外活动兴趣小组为探究铜跟硫酸反应的情况,设计如下图示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL 18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
① 写出上述过程中烧瓶内发生反应的化学方程式:
___________________________________、__________________________________。
② B是用来收集实验中产生的气体的装置,但导管未画全,请把导管补充完整;(在原图中补充)
③ 实验结束后,装置C中的溶液中可能含有的溶质有__________________________.
(2)该小组的同学对“浓硫酸的浓度小于什么值时就不和铜反应”这个问题很感兴趣。为了获得这个值,你认为他们可以采用的方法是_________(填字母,答案不唯一 ).
A.做实验 B.查资料 C.请教老师和其他同学等 D.猜测
(3)事实表明,铜与浓硫酸反应全部结束后,硫酸仍有剩余。为了定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲同学设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种________________________________________________。②乙同学设计的方案是:将反应后的溶液冷却后全部移入100ml容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量浓度。你认为乙同学设计的实验方案能否准确求得余酸的物质的量浓度______(填“能”或“否”),理由是______________________________________。
26.(1)2Cu+O2+2H2SO4→2CuSO4+2H2O,形成了原电池(2)丙,丁,
(3)乙戊,戊(4)甲,加热蒸发、冷却结晶、过滤并洗涤晶体,循环使用。
26.(十四校一)化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中置一些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
|
|

 乙组:Cu
CuO
CuSO4
乙组:Cu
CuO
CuSO4
|
 丙组:Cu
CuSO4
丙组:Cu
CuSO4
|
|
|


 丁组:Cu
Cu(NO3)2
Cu(OH)2
CuSO4
丁组:Cu
Cu(NO3)2
Cu(OH)2
CuSO4
|
 戊组:Cu
CuSO4
戊组:Cu
CuSO4
(1)甲组实验可用一个化学反应方程式表示为 ,使反应变快的可能原因是 。
(2)在五个方案中,科学性有错的是 组方案,经济性最差的是 组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用 组方案;②无污染,这应排除 组方案。
(4)相对能耗低,污染小的是 组方案。该给从反应器中排出的溶液中(含有少量H2SO4以抑制水解)取得产品的实验操作步骤应为 、 、 ,对取得产品后残留物质的处理方法是 。
20.(黄浦二)设阿伏加德罗常数的数值为NA,下列说法正确的是( )
 A.常温常压下,1 mol氦气含有的核外电子数为4 NA
A.常温常压下,1 mol氦气含有的核外电子数为4 NA
B.常温常压下,62g白磷分子( )中的共价键数目为3 NA
C.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
D.标准状况下,NA个NO分子和0.5 NA个O2分子混合后气体的总体积为33.6 L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com