
9.(虹口一) 用NA表示阿伏伽德罗常数,下列说法中正确的是( )
A.如果5.6L N2含有n个氮分子,则NA一定约为4n
B.2.0gD2O中所含中子数为0.1NA
C. 1.4g乙烯和丙烯的混合物中含共价键数为0.3NA
D.O.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA
8.(南汇一)NA表示阿佛加德罗常数,下列叙述中指定粒子数目一定大于NA的是( )
A.11.5L N2和NO的混合气体所含的原子数
B.12g 14C中所含的碳原子数
C.28g铁在反应中作还原剂时,失去电子的数目
D.1 L 0.1 mol·L-1 CH3COOH溶液中所含的分子总数
20、(闸北一)设NA为阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,密度为d g/L的某气体纯净物一个分子的质量为g
B.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C.25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子
D.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子
8.(闵行一)设NA表示阿伏加德罗常数,下列说法错误的是( )
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3溶液中含有NA个Fe3+
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
19. (普陀一)NA为阿伏加德罗常数,下列说法中错误的是 ( )
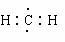 A. 标准状况下14 g 碳烯(
)所含的电子数为8NA
A. 标准状况下14 g 碳烯(
)所含的电子数为8NA
B. 常温常压下1 mol NO2气体与水反应生成NA个NO3– 离子
C. 常温常压下32 g O2– 离子中所含电子的数目为17NA
D. 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2失去的电子数均为2NA
9.(卢湾一)NA代表阿伏加德罗常数,下列说法正确的是( )。
A.7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA
B.标准状况下,22.4L辛烷完全燃烧生成二氧化碳分子数为8NA
C.2mol的甲基(-CH3)与2mol的羟基(-OH)所含电子数均为18NA
D.某条件下将1molN2和3molH2在密闭容器中充分反应,生成NH3分子数为2NA
31、(1)NH4+ SO42-
(2) n(SO42-) =0.2mol n(NH4+)=0.1 mol n(Al3+)=0.1 mol n(H2O)=1.2mol
该结晶水合物的化学式为:NH4 Al (SO4)2·12H2O [或(NH4)2SO4·Al2(SO4)3·24H2O]
(3)①100 ②
31.(普陀二)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是Al3+和________,阴离子是________。
(2)试通过计算确定该结晶水合物的化学式。
计算过程:
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol·L-1。
①加入 mLBa(OH)2溶液时,所得沉淀的总物质的量最大。
②请在下图中画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图。
30、(1)x=1 (2分)(2)14.4 (2分) (3)6 (2分)
30、(闸北二)白云石化学式为CaCO3·x MgCO3。以它为原料,可制取耐火材料MgO等。称取27.6 g白云石样品,高温加热到质量不再变化,收集到CO2的体积为6.72 L(标准状况)。
(1)计算白云石化学式中的X值
(2)该样品高温条件下充分反应后剩余固体的质量?
(3)该样品高温条件下充分反应后剩余固体中MgO的质量?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com