
28.(每小题2分,共4分)红磷 ; 低
1、B2、A3、B4、B5、B6、C7、A8、C9、C10、D11、D12、B13、B14、A15、C16、D17、D18、A19、B20、A21、C22、C23、C24、C25、B26、C27、A
第Ⅰ卷 (选择题 共54 分)
32.(8分)
请回答下列问题:
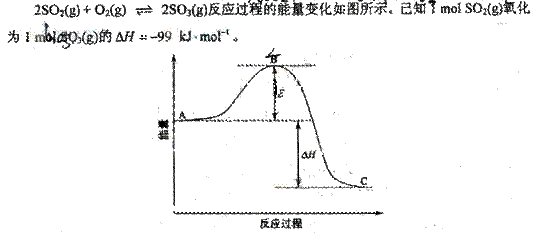
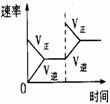
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;(2)图中△H= kJ·mol-1。
31.(14分)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为O。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为O。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol·L-1·min-1。
(2)在实验2,A的初浓度C2= mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<)。且C3 mol·L-1 ( 填>、=、< )。
(4)比较实验4和实验l,可推测反应是 反应(选填吸热、放热)。理由是 。
30.(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s) + 6C(s)+ 2N2(g) 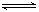 Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
 (1)该反应的氧化剂是
,其还原产物是
;
(1)该反应的氧化剂是
,其还原产物是
;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)= 。
28.(4分)同素异形体相互转化的反应热相当小而且转化率较慢,有时还不完全,测定反应热很困难。已知
P4(s,白磷)+ 5O2(g)= P4O10(s) DH=-2983.2kJ/mol
P(s,红磷)+ 5/4 O2(g)= 1/4 P4O10(s) DH=-738.5kJ/mol
相同状况下,能量状态较低的是______ ___;白磷的稳定性比红磷_________(填“高”或“低”)。
|
 29.(6分)
29.(6分)
(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________。
|
DH=____________kJ· 。
。
(3)火箭发射时可用肼(N2H4)为燃料,以NO2作氧化剂,它们相互反应生成N2和H2O.已知:
N2(g)+2O2(g)=2NO2(g) DH=+67.7kJ / mol
N2H4(g)+O2(g) =N2(g)+2H2O(g) DH=-534kJ / mol
则N2H4和NO2反应的热化学方程式为 。
27. 用来表示可逆反应2A(g) + B(g) 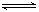 2C(g) DH<0 的正确图像为
2C(g) DH<0 的正确图像为
|
|
 时间 时间浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
第Ⅱ卷(非选择题 共46分)
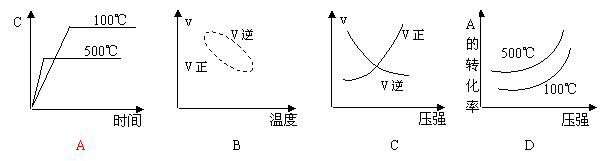
26.对于可逆反应N2(g)+3H2(g)
 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
|
|
A |
B |
C |
D |
|
研究目的 |
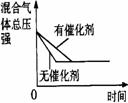
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
|
图示 |
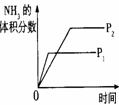 |
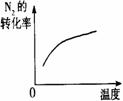 |
 |
 |
25. 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
 下列说法错误的是:
下列说法错误的是:


 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B. 增大压强使平衡向生成Z的方向移动,平衡常数增大
B. 增大压强使平衡向生成Z的方向移动,平衡常数增大
 C. 反应可表示为X+3Y
C. 反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com