
8.常温时,将VlmLC1mol·L-1的氨水滴加到V2mLC2mol·L-1盐酸中,下述结论中正确
的是 ( )
A.若混合溶液的pH=7,则C1V1>C2V2
B.若Vl=V2,C1=C2则混合液中c(NH4+)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则-定有C1<C2
7.中和一定量的某种醋酸溶液耗agNaOH。若先在该醋酸溶液中溶入少量CH3COONa,再用NaOH中和滴定,耗bgNaOH。则a和b的关系是 ( )
A. a>b B. a<b C. a=b D. 无法确定
6.用物质的量浓度为0.1mol/L的盐酸和醋酸溶液,分别中和等体积pH=12的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积是V1和V2,则V1和V2的关系正确的是 ( )
A.V1<V2 B.V1=V2 C.V1>V2 D.V1≤V2
5.下列溶液一定碱性的是 ( )
A.溶液中c(OH-)>c(H+) B.溶液中含有OH‑离子
C.滴加甲基橙后溶液显红色 D.滴加甲基橙后溶液显黄色
4.用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是 ( )
A.6.9-7.1 B.3.3-10.7 C.4.3-9.7 D.6-8
3.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.0mL刻度处.把滴定管中的溶液
全部流下排出,承接在量筒中,量筒内溶液的体积 ( )
A.大于40.0mL B.为40.0mL C.小于40.0mL D.为10.0mL
2.下列几种情况对中和滴定结果无影响的是 ( )
A.盛待测液的锥形瓶里留有蒸馏水
B.滴定管尖嘴部分在滴定前有气泡
C.滴定管在滴定前未将刻度调在“0”,而调在“2.40”
D. 滴定达终点时,视线高于滴定管内液体的凹面的最低点
1.用标准盐酸溶液滴定未知浓度的NaOH溶液时,若测得结果偏高,则产生误差的原因可能是
A.滴定时,装未知浓度NaOH溶液的锥形瓶忘记用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗干净后, 忘记用标准盐酸润洗
C.滴定时,滴定管的尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
6、误差分析(重点与难点)
例如,用已知浓度的盐酸滴定未知浓度的NaOH溶液。
c酸V酸==c碱V碱
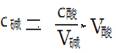
式中:c酸为标准溶液的准确浓度(不变量),V碱为待测液的体积(不变量)。
显然,影响NaOH溶液浓度的因素是标准溶液的体积读数,若消耗标准溶液比理论值多,则测定结果偏高;若消耗标准溶液比理论值少,则测定结果偏低。简化为“多则高,少则低”。
中和滴定过程中,容易产生误差的6个方面是:
⑴洗涤仪器:(滴定管、移液管、锥形瓶);
⑵气泡;
⑶体积读数(仰视、俯视);
⑷指示剂选择不当;
⑸杂质的影响;
⑹操作(如用力过猛引起待测液外贱等)。
具体分析如下:
⑴滴定前,在用蒸馏水洗涤滴定管后,未用HCl标准溶液润洗酸式滴定管就装液进行滴定。
⑵滴定前,有气泡,滴定后气泡消失。
⑶滴定前,用待测液润洗锥形瓶。
⑷取待测液时,移液管用蒸馏水洗涤后,未用待测液润洗。
⑸取液时,移液管尖端的残留液吹入锥形瓶中。
⑹读取标准液的刻度时,滴定管开始前平视读数,滴定终了时俯视读数。
⑺若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。
⑻滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
⑼滴定后,滴定管尖端挂有液滴未滴入锥形瓶中。
⑽滴定管开始前仰视读数,滴定终了时俯视读数。
⑾滴定过程中,向锥形瓶中加入少量蒸馏水。
⑿滴定过程中,滴定管漏液。
⒀滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中。
⒁过早估计滴定终点。
⒂过晚估计滴定终点。
⒃一滴标准溶液附在锥形瓶壁上未洗下。
⑴偏高⑵偏高⑶偏高⑷偏低⑸偏高⑹偏低⑺偏高⑻偏低⑼偏高⑽偏低⑾无影响⑿偏高
⒀操作正常,无影响⒁偏低⒂偏高⒃偏高
专题训练
5、读数与记录
滴定管的“0”刻度在上端(与量筒相反),读书时,视线平视,不能仰视或俯视。记录数据要与实验条件的精确度一致(如12.5mL).要求把同一样品滴定两次,取两次测定数据的平均值计算结果。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com