
14.下列能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.工业上由氢气和氮气合成氨(正反应为放热反应)是在较高温度下进行的
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
13.一定温度下,向 a L密闭容器中加入1 mol X 气体和2 mol Y 气体,发生如下反应:
X(g) + 2Y(g) 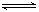 3Z(g) ,此反应达到平衡的标志是
3Z(g) ,此反应达到平衡的标志是
A.容器内压强不再随时间变化 B.容器内各物质浓度不再随时间变化
C.容器内X、Y、Z的浓度比为1:2:3 D.单位时间内消耗0.1 mol X 的同时生成0.3 molZ
12.对于某一反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率 B.以同样程度改变正逆反应速率
C.增大正反应速率,减小逆反应速率 D.改变平衡混合物的组成
11.在反应N2(g)
+ 3H2(g)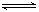 2NH3(g)
△H<0 的平衡体系中,当分离出氨时,下列说法中正确的是
2NH3(g)
△H<0 的平衡体系中,当分离出氨时,下列说法中正确的是
A. 正反应速率增大 B. 平衡向逆反应方向移动
C. 正反应速率先变大后变小 D. 逆反应速率先变小后逐渐变大
10.在一可变容积的密闭容器中进行反应:C(s)+ H2O(g)= CO(g) + H2(g),下列条件的改变对反应速率几乎无影响的是
A.增加C的量 B.将容器的体积缩小一半
C.升高温度 D.保持压强不变,充入N2,使容器的体积变大
9.下列说法正确的是
A.增大反应物浓度,可增加反应物分子中活化分子的百分数,从而使有效碰撞次数增大。
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数,从而使反应速率增大。
C.升高温度能使化学反应速率增大,原因是增加了反应物分子中活化分子的百分数。
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率。
8.反应2SO2+O2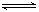 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
A.0.1 s B.2.5 s C.5 s D.10 s
7.已知下列热化学方程式:C(s)+O2(g)=CO2(g) DH=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(g) DH=-483.6kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气、固混合物在氧气中完全燃烧,共放出63.53kJ热量,则炭粉与氢气的物质的量之比为
A.1∶1 B.1∶2 C.2∶3 D.3∶2
6.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) DH=+890KJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) DH= +890KJ·mol-1
C.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) DH=-890KJ·mol-1
D.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) DH= -890KJ·mol-1
5.已知在298K时下述反应的有关数据:C(s)+1/2O2(g)=CO(g) △H1 = -110.5kJ/mol
C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mol 则C(s)+ CO2(g)=2CO(g) 的△H
A.283.5kJ/mo B.172.5kJ/mol C.-172.5kJ/mol D.-504 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com