
3.判断氧化剂的氧化性强弱,还原剂的还原性强弱的常见方法:
(1)同种元素不同价态物质之间的比较:
(2)根据元素周期律比较:
(2)
 根据金属活动顺序表比较:
根据金属活动顺序表比较:
(3) 根据反应条件比较:
(4) 根据具体反应判断:
[例题解析]
[例1]已知Br2 +2Fe2+=2Fe3++2Br-、2Fe3++2I- =2Fe2++I2
氧化剂的氧化性强弱顺序为: ;
还原剂的还原性强弱顺序为: 。
解题思路: 。
易错点: 。
[例2] 在化学反应a Zn +b HNO3(稀)= c Zn(NO3)2 +d NO↑+ e H2O 中,
若e的值为4,则d的值 ( )
A、1 B、2 C、3 D、4
解题思路: 。
易错点: 。
[考题再现]
2.配平下列氧化还原反应方程式,标出电子转移方向和数目,指出氧化剂、
还原剂,氧化产物、还原产物
(1) Fe3C + HNO3= Fe(NO3)3+ CO2+ NO2+ H2O
(2)P4+ CuSO4+ H2O= Cu3P+ H3PO4+ H2SO4
以上两个反应中,1mol氧化剂分别氧化了 mol的还原剂。
1.K2Cr2O7 + HCl = KCl + CrCl3 + Cl2 + H2O
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)参加反应的盐酸中,起还原剂作用的盐酸与起酸作用的盐酸的质量比为
(4)用短线桥标出电子转移方向和数目
3.

|
|
|
|



氧化剂:得(电子)→降(价降低)→还(还原反应, 被还原)→还(还原产物)
还原剂:失(电子)→升(价 )→氧( , 被 )→氧( )
2.氧化还原反应: 。
(1)氧化剂: 、(2)还原剂 、
(3)被氧化: 、(4)被还原 、
(5)氧化产物: 、(6)还原产物 。
1.化学反应的分类:
。
例22、KMnO4+ H2C2O4+ H2SO4=== CO2+ MnSO4+ K2SO4+ H2O
有机物参加的氧化还原反应,变价元素往往有碳,可采用氢氧标碳标出碳元素化合价。 例23.单质铁溶于一定浓度的硝酸中反应的化学方程式如下: a Fe+b NO3-+c H+==d Fe2++f Fe3++g NO↑+h N2O↑+k H2O(系数均为自然数) (1)c、g、h的关系式是_____________________________(原子守恒) (2)b、c、d、f的关系式是__________________________(电荷守恒) (3)d、f、g、h的关系式是___________________________(得失电子守恒) 八、.氧化还原反应有关计算(得失电子守恒) 计算公式: n(氧化产物)×变价原子个数×化合价变化值==n(还原产物)×变价原子个数×化合价变化值 n(氧化剂)×变价原子个数×化合价变化值==n(还原剂)×变价原子个数×化合价变化值 例24.硫酸铵在强热条件下分解,生成NH3、SO2、N2、H2O,反应中生成的氧化产物和还原产物的物质的量之比是( )。 A. 1:3 B. 2:3 C. 1:1 D. 4:3 例25、24 mL浓度为0.05 mol/L的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )。 A.+2 B+3 C.+4 D.+5 例26.1.92克铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色慢慢变浅,当铜反应完毕时,共收集到标况下的气体1.12 L(不考虑NO2与N2O4的转化),计算(1)参加反应的硝酸的物质的量(2)生成气体中各成分的物质的量(3)将生成的气体与多少mol O2混合溶于水,才能使气体全部被吸收? 例27、高锰酸钾和氢溴酸溶液发生如下反应: KMnO4+ HBr-- Br2+ MnBr2+ KBr+ H2O(未配平) 其中,还原剂是 ,若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量是 ,被氧化的Br-与未被氧化的Br-的个数之比是 。 例28、在化学反应:3BrF3+5H2O==Br2+HBrO3+O2+9HF中,若有5.4g水被氧化,则被水还原的BrF3的物质的量是 mol。 例29、R2O8n-离子在一定条件下可以把Mn2+氧化成MnO4-,若反应后R2O8n-离子变为RO42-,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n值为 A.1 B.2 C.3 D.4 九.氧化还原反应的应用 辨析:下列反应中,所述物质或过程全部发生氧化反应的是 A.HClO、H2O2、O3等具有很好杀菌消毒作用 B.橡胶老化,钢铁生锈,白磷自燃 C. 铁、铝遇浓硫酸、浓硝酸发生钝化 D.在催化剂作用下,乙醇变为乙醛,乙醛变为乙酸 E.苯酚久置在空气中变为粉红色,Fe(OH)2露置在空气中最终变为红褐色。 F.丙烯、油酸等使酸性KMnO4溶液、溴水褪色 G.为防食物变质,常加入VC等食品添加剂。 H.原电池负极发生的反应,电解池阴极发生的反应 I. SO2使酸性KMnO4溶液、溴水、品红溶液褪色 J.植物光合作用,呼吸作用 K葡萄糖作为能源物质为人体提供能量。 十、信息方程式书写 1、工业上,若输送Cl2的管道漏气,用NH3进行检验时可观察到大量白烟,同时有N2生成,写出此反应的化学方程式: ; 2、在密闭容器中,将足量的溴跟NaOH充分反应,发现低温时只有1/2的溴(质量)转化为NaBr,而高温时只有5/6的溴(质量)转化为NaBr。则低温时的化学反应方程式为: ;高温时的化学反应方程式为: 。 3、等物质的量的Fe3O4和Pb3O4分别与浓盐酸反应时,所消耗HCl的物质的量相等。不同的是,高价的铅能将盐酸氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式: 、 。 4、氟气通入稀的NaOH溶液中,反应生成氟化钠的同时放出一种气体X,X由两种元素组成,且其中氟元素的质量分数是70.4%,请写出此反应的化学方程式: 。 5、我国古代四大发明之一的黑火药是由木炭、硫磺、火硝(硝酸钾)按一定比例混合而成,爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为_______________ 。 6、在一定条件下1 molCl2与2 mol KOH在溶液中反应得到乙和丁,n(乙) :n(丁)=5:1,该反应的离子方程式为_____________________________________。
2. 已知中心在原点的双曲线C的右焦点为(2,0),右顶点为 。
。
(1) 求双曲线C的方程;
(2)
若直线l: 与双曲线C恒有两个不同的交点A和B,且
与双曲线C恒有两个不同的交点A和B,且 (其中O为原点),求k的取值范围。
(其中O为原点),求k的取值范围。
教学反思:
由于向量既能体现“形”的直观位置特征,又具有“数”的良好运算性质,是数形结合与转换的桥梁和纽带。而解析几何也具有数形结合与转换的特征,所以在向量与解析几何知识的交汇处设计试题,已逐渐成为高考命题的一个新的亮点。本节问题立足基础,适当综合,巧设问题,分类解析,有条理有内容有方法有深度,正确理解和发动学生多看、多想、多操作、多反思总结,突出学生主体地位,较好的完成教学目标。
附板书设计:
|
3.⑴ ⑵ k的取值范围是(-1,1)。
⑵ k的取值范围是(-1,1)。
从上述几例可以看出,只要对于解析几何中图形的位置关系和数量关系进行认真分析,充分挖掘问题的向量背景,注意运用曲线参数方程的点化作用,就完全有可能获得一个漂亮的向量解法。
课时小结
向量具有数形兼备的特点,成为了作为联系众多知识的桥梁,向量与三角、解析几何、立体几何的交汇是当今高考命题的必然趋势,本节处理了三类问题,即利用向量解决解析几何中有关平行、共线问题,长度、角度、垂直及轨迹和综合应用问题。
布置作业:
1已知椭圆方程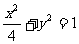 ,过B(-1,0)的直线l交随圆于C、D两点,交直线x=-4于E点,B、E分
,过B(-1,0)的直线l交随圆于C、D两点,交直线x=-4于E点,B、E分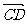 的比分λ1、λ2.
的比分λ1、λ2.
求证:λ1+λ2=0
3.已知点G是△ABC的重心,A(0, -1),B(0, 1),在x轴上有一点M,满足| |=|
|=| |,
|, (
( ∈R).
∈R).
⑴求点C的轨迹方程;
⑵若斜率为k的直线l与点C的轨迹交于不同两点P,Q,且满足| |=|
|=|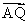 |,试求k的取值范围.
|,试求k的取值范围.
答案1.B 2.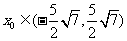
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com