
17.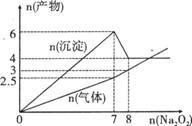 将Na2O2逐渐加入到含有A13+、Fe2+的混合液
将Na2O2逐渐加入到含有A13+、Fe2+的混合液
中,产生沉淀和气体的物质的量(mol)与加入
Na2O2的物质的量(mo1)的关系如图所示,则原
溶液中A13+、Fe2+的物质的量分别为( )
A.4mol、2mol B.2mol、4mol
D.1mol、2mol D.2mol、1mol
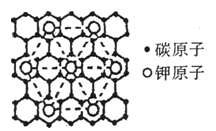
16.石墨能与熔融金属钾作用,形成石墨间隙化
合物,K原子填充在石墨各层碳环中。比较
常见的石墨间隙化合物是化学式为KCx的
青铜色化合物,其平面图形如图。则x值
为 ( )
A.8 B.12
C.24 D.60
15.以下说法正确的是 ( )
A.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关。
B.非金属元素的原子间只形成共价键,金属元素的原子与非金属元素的原子间只形成离子键。
C.原子晶体的原子间只存在共价键,而形成分子晶体的原子间均存在分子间作用力。
 D.原子是化学变化中的最小微粒,意即化学变化不产生新元素,核反应产生了新元素不为化学变化。
D.原子是化学变化中的最小微粒,意即化学变化不产生新元素,核反应产生了新元素不为化学变化。
14.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是 ( )
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水。
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+。
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-。
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+。
13.现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是 ( )
A.若混合前三溶液pH相等,将它们同等倍数稀释后,NaOH溶液pH最大
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
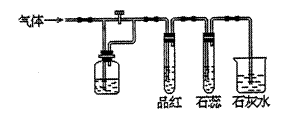
12.如图装置中,若关闭活塞,则品红溶液无
变化,石蕊试液变红,石灰水变浑浊,若
打开活塞,则品红溶液褪色,石蕊试液变
红,石灰水变浑浊.据此判断气体和广口
瓶中盛放的物质是 ( )
A.H2S和浓H2SO4 B.SO2和NaHCO3溶液
C.Cl2和NaHCO3溶液 D.Cl2和氯水
11. 对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中不正确的
pC(g)+qD(g);△H<0。下列结论中不正确的
是 ( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.56倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
 D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
10.盐类水解程度的大小可用“水解度”来表示,NaA型盐的水解度为已水解的离子的物质的量占该离子原来总物质的量的百分数。用0.040 mo1·L-1 NaOH溶液10.0 mL与
|
A.0.25% B.0.50% C.0.75% D.1.0%
9.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体。在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中不正确的是 ( )
A.NH5属于离子晶体 B.NH5属于分子晶体
C.NH5与水的反应是氧化还原反应 D.NH5与NH3溶于水后均呈碱性
8.下列叙述中,正确的是 ( )
A.C4H10的一种同分异构体只能生成一种一氯代物
B.CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上
C.某物质的名称为:2-乙基-1-丁烯
D.制取1,2-二溴乙烷的最合理的方法是乙烯与HBr进行加成反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com