
4.如图所示,理想变压器原、副线圈的匝数比为1:10,b是原线圈的中心抽头,电压表和电流表均为理想电表,从某时刻开始在原线圈c、d两端加上交变电压,其瞬时值表达式为u1=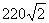 sin100πt(V),则下列说法不正确的是( )
sin100πt(V),则下列说法不正确的是( )
A.当单刀双掷开关与a连接时,若n2=100匝,则输出端线圈的磁通量变化率的最大值为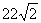 Wb/s
Wb/s
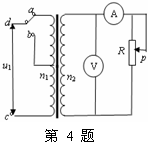 B.单刀双掷开关与b连接,在t=
B.单刀双掷开关与b连接,在t=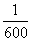 s时,电压表上的示数为4400V
s时,电压表上的示数为4400V
C.单刀双掷开关与a连接,在滑动变阻器触头P向上移动的过 程 中, 电压表和电流表的示数均变小
D.当单刀双掷开关由a扳向b后,电压表和电流表的示数均变大
3.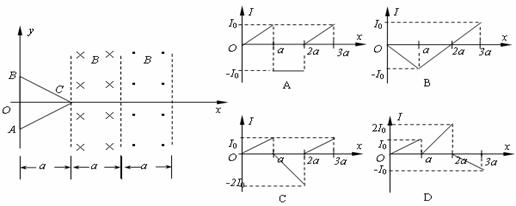 如图所示,两个垂直纸面的匀强磁场方向相反,磁感应强度的大小均为B,磁场区域的宽度均为a,一正三角形(高为a)导线框ABC从图示位置沿图示x轴正方向匀速穿过两磁场区域,以逆时针方向为电流的正方向,在图中感应电流I与线框移动距离x的关系图象正确的是 ( )
如图所示,两个垂直纸面的匀强磁场方向相反,磁感应强度的大小均为B,磁场区域的宽度均为a,一正三角形(高为a)导线框ABC从图示位置沿图示x轴正方向匀速穿过两磁场区域,以逆时针方向为电流的正方向,在图中感应电流I与线框移动距离x的关系图象正确的是 ( )
2.将一只苹果斜向上抛出,苹果在空中依次飞过三个完全相同的窗户1、2、3.图中曲线为苹果在空中运行的轨迹.若不计空气阻力的影响,以下说法正确的是( )
A.苹果通过第1个窗户所用的时间最长
 B.苹果通过第3个窗户的平均速度最大
B.苹果通过第3个窗户的平均速度最大
C.苹果通过第1个窗户重力做的功最大
D.苹果通过第3个窗户重力的平均功率最小
1. 2009年4月15日零时16分,我国第二颗北斗导航卫星在西昌卫星发射中心发射成功,这颗卫星是中国“北斗二号”卫星导航系统建设计划中的第二颗组网卫星,是地球同步静止轨道卫星。我国还将在今年和明年两年发射10颗左右的导航卫星,预计在2015年建成由30多颗卫星组成的、覆盖全球的“北斗二号”卫星导航定位系统。关于第二颗北斗导航卫星,下列说法中正确的是( )
A.该卫星相对于地球静止,其运行速度等于地球赤道处自转的线速度
 B.该卫星处于完全失重状态,卫星所在处的重力加速度为零
B.该卫星处于完全失重状态,卫星所在处的重力加速度为零
C.该卫星若受到太阳风暴影响后速度变小,它的轨道半径将变大
D.该卫星一定不会运动到北京正上方天空
33. (16分)从某些植物树叶提取的挥发油中含有下列主要成分:
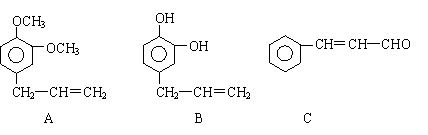
(1)有关A、B、C三种物质的说法正确的是 (填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为 。
(3)0.5molB与足量的溴水充分反应,消耗 mol单质溴。
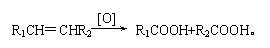
(4)已知: 有机物C9H8O发生如下反应:
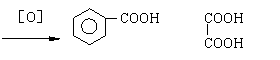
C9H8O +
则C9H8O的结构简式为 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
2010届佛山市普通高中高三教学质量检测(二)
32.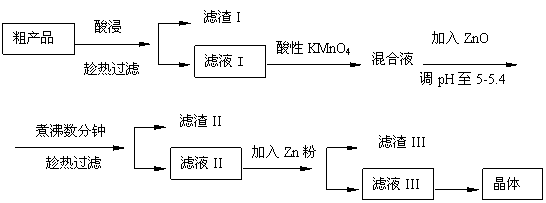 (16分)从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到纯净的硫酸锌,实验流程如下:
(16分)从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到纯净的硫酸锌,实验流程如下:
|
沉淀物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
Cd(OH)2 |
Mn(OH)2 |
|
pH值 |
8.0 |
9.7 |
3.2 |
6.7 |
9.4 |
10.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH参见上表,请回答下列问题:
(1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有 。“酸浸”时适当补充少量水的原因是 。
(2) 滤液I加入酸性KMnO4所发生反应的离子方程式为 。
加入ZnO的原因是 。
(3) 滤渣III的成份主要是 。
(4)从滤液III得到晶体的操作过程为 、冷却结晶、过滤冼涤、小心干燥。
31. (16分)I.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 K= 1.75×10-5
碳酸 K1= 4.30×10-7 K2= 5.61×10-11
亚硫酸 K1= 1.54×10-2 K2= 1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式:K1= 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > > 。
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
A. c(CH3COO-) B. c(H+) C.醋酸电离平衡常数 D.醋酸的电离程度
II.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
KSP |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(4)你认为往废水中投入 (填字母序号),沉淀效果最好。
A. NaOH B. Na2S C. KI D. Ca(OH)2
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(r≈1g·mL-1)。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)= 。[已知M(NaCl)=58.5,KSP(AgCl)=1.8×10-10mol2·L-2]。
30. (16分)某校化学研究性学习小组为探究Cu(OH)2受热分解产物及产物性质设计如下实验过程:
(1)取0.98 g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示:
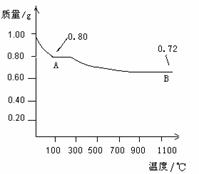
产物A、B的化学式分别为 和Cu2O。
(2)为探究产物A能否被NH3还原设计如下实验装置(夹持及尾气处理装置未画出)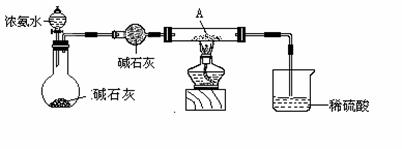
实验中观察到A变成红色物质,同时生成一种无污染的气体,该气体的化学式为 。有人认为在装A物质的试管与烧杯之间需加一个防倒吸装置,你认为是否有必要 ,(填“有”或“没有”)原因是 。
(3)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为 。
(4)通过以上实验可以判断出A与B的稳定性大小的结论是:
高温时 ;在酸性溶液中 。(用A、B的化学式表示)。
23.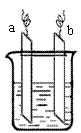 右图中,两电极上发生的电极反应分别为:
右图中,两电极上发生的电极反应分别为:
a极:2Ag++2e-=2Ag b极:Fe-2e-=Fe2+ 下列说法不正确的是
A.该装置一定是电解池
B.a、b可能是同种电极材料
C.装置中电解质溶液不一定含有Ag+
D.装置中发生的反应方程式一定是Fe+2Ag+=Fe2++2Ag
22. 在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:
N2(g)+3H2(g) 2NH3(g) △H= -92.4 KJ/mol,下列结论正确的是
2NH3(g) △H= -92.4 KJ/mol,下列结论正确的是
A.该反应达到平衡时,放出的热量等于92.4KJ
B.达到平衡后向容器中通入1mol氦气,平衡不移动
C.降低温度和缩小容器体积均可使该反应的平衡常数增大
D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时起始时的90%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com