
3.已知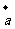 (tanθ,一1),
(tanθ,一1),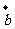 =(l,一2),若(
=(l,一2),若(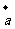 +
+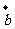 )⊥(
)⊥(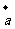 -
-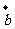 ),则tanθ= ( )
),则tanθ= ( )
A.2 B.-2 C.2或-2 D.0
2.若集合A={x|x2 -1 <0,x∈R},集合B满足A∩B =A∪B,则CAB为 ( )
A.(-l,1) B.(-∞,-1) ∪[1,+ oo]
C.(1,+∞) D.(-∞,-1) ∪(1,+∞)
1.复数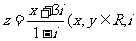
 是虚数单位)是实数,则
是虚数单位)是实数,则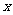 的值为 ( )
的值为 ( )
A.3 B.-3 C.0 D.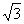
22. 有硫酸钾和碳酸镁的混合物,用50 mL盐酸完全溶解后,在标准状况下收集到0.56 L二氧化碳,向反应后的溶液中加入含有0.03 mol氢氧化钡的溶液,可得到6.11 g沉淀,此时溶液的pH=12,溶液的体积为200 mL,试求:
(1)原混合物中碳酸镁的质量。
(2)得到的沉淀中硫酸钡的质量。
21. 为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
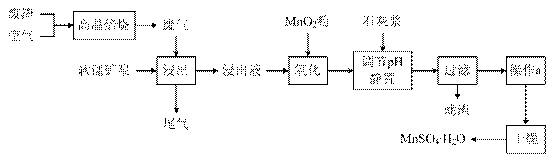
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:_____________________________________。
(2)写出氧化过程中主要反应的离子方程式:_____________________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________________。
(4)滤渣的主要成分有_________________________________________。
(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液 d. 氨水、酚酞试液
(6)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3废气,可得到硫酸锰晶体质量为___________________。
19.
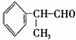 氢化阿托醛是一种重要的化工原料,其合成路线如下:
氢化阿托醛是一种重要的化工原料,其合成路线如下:
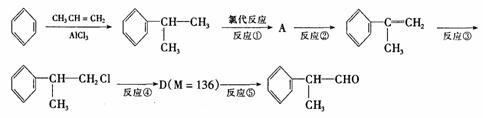
(1)氢化阿托醛被氧化后的含氧官能团的名称是 。
(2)在合成路线上②③的反应类型分别为② ③ 。
(3)反应④发生的条件是 。
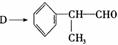
(4)由 反应的化学方程式为 。
(5)1mol氢化阿托醛最多可和______mol氢气加成,1mol氢化阿托醛发生银镜反应可生成__________molAg。
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为 。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有 种。
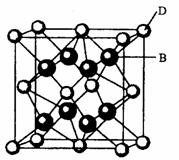 20.
20.
有A、B、C、D、E、F六种元素,A是周期表中原
子半径最小的元素,B是电负性最大的元素,C的2p轨
道中有三个未成对的单电子,F原子核外电子数是B与
C核外电子数之和,D是主族元素且与E同周期,E能
形成红色(或砖红色)的E2O和黑色的EO两种氧化物,
D与B可形成离子化合物其晶胞结构如右图所示。请
回答下列问题。
(1)E元素原子基态时的电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ,F的氧化物FO3分子空间构型为
;
(3)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
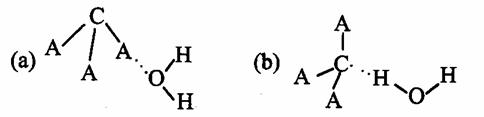 。
。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是 (写出表达式即可)。
17.(1)已知4g甲烷气体充分燃烧生成CO 2(g)和H2O(l)时,放出Q kJ的热量。甲烷燃烧的热化学方程式为_____________________________________________。
(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中。反应方程式为H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl-质量分数低于0.2%。
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl-质量分数低于0.2%。
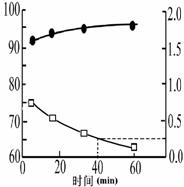
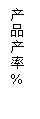


 由图中可知,当反应进行到约
min时,KDP晶体达到一级品标准,此时的产品产率约为
。
由图中可知,当反应进行到约
min时,KDP晶体达到一级品标准,此时的产品产率约为
。
(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为 。
②在状态A时,平衡常数KA= (代入数值即可)当温度由T1变到T2时,KA KB(填“>”、“<”或“=”)
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)一样大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
|
(1)一定温度下,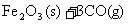
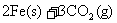
①请用上述反应中某种气体的有关物质理量来说明反应已达平衡状态(若有多种,只回答两种即可)
i
ii
②若平衡时,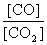 比值随温度的升高而增大,则该反应的正反应是
反应(填“吸热”或“放热”)
比值随温度的升高而增大,则该反应的正反应是
反应(填“吸热”或“放热”)
(2)钢铁发生电化腐蚀时,负极电极反应式为
(3)水体中铅污染问题备受关注,铅在水溶液中的各种存在形态浓度分数随溶液pH变化关系如图所示。
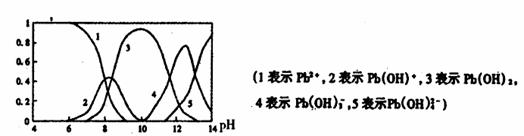
①往Pb(NO3)2溶液中滴入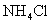 溶液后,
溶液后,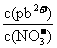 减小,可能的原因是
减小,可能的原因是
②向铅污染的水中加入脱铅剂(用EH表示),脱铅过程中主要发生如下反应:

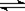

则:该反应的平衡常数数表达式为K= ;脱铅反应最合适的pH范围为6-7,请解释原因:
③向含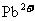 的污水中加入FeS固体,也可除去
的污水中加入FeS固体,也可除去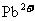 的污染,当
的污染,当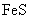 合
合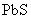 同时存在时,溶液中
同时存在时,溶液中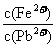 =
[已知:
=
[已知: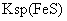 =6.8×10-18mol2·L-2;
=6.8×10-18mol2·L-2;
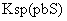 =3.4×10-28 mol2·L-2]
=3.4×10-28 mol2·L-2]
16.运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
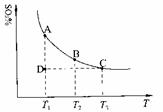
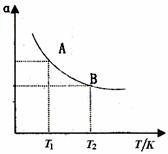
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
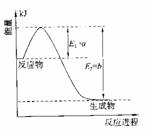 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成
1molNH3过程中能量变化示意图,请写出工业合成氨
的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1
的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中
显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时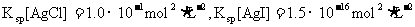 )
)
0.110g的镁带,把数据记录于表格。
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20ml水,
再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧
加料口。
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外
液面持平。
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头。
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格。
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格。
重复上述操作进行第二次实验,避免偶然误差。
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa。该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞, 可以确认装置气密性合格。
(2)B中所装液体一般是 (填“水”或“品红”)。
A中发生反应的离子方程式为 。
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
|
实验次数 |
m(Mg) g |
硫酸体积ml |
液体量瓶中液体体积ml |
抽出气体体积ml |
氢气体积ml |
计算1mol氢体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
X |
|
|
2 |
0.115 |
10.0 |
121.0 |
8.0 |
|
|
①上表中X= 。
②计算1mol氢气体积两次实验的平均值= L。
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误关的可能原因 (填字母)
A.镁带中含有跟硫酸不反应的杂质 B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝 D.所用稀硫酸不足量
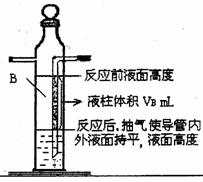 (4)许多同学在实验中测得的数据偏高(记录数据时
(4)许多同学在实验中测得的数据偏高(记录数据时
已恢复至室温)。为此,某化兴趣小组的同学对此
实验方案提出了两条修正建议①A、B瓶的气体
中含有水汽,增加的气体体积中所含的水汽,不
该计入氢气的体积。②B瓶中导管(图中阴影部
分VB)内液柱部分在反应后为空气所占据,不该
计入氢气的体积。你认为他们的意见合理的是
(合理则填序号,否则填“无”)
如有合理之处,请根据下面的数据给出修正的
1mol氢气体积的数学表达式。(镁元素的相对原子质量为24.3)
|
实验次数 |
m(Mg) g |
硫酸体积ml |
液体量瓶中液体体积ml |
抽出气体体积ml |
B瓶的一段液柱体积ml |
水汽体积百分含量 |
计算1mol氢体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
VB |
a% |
|
1mol氢气体积= L(填写数学表达式)。
14.聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”。其合成路线如下:
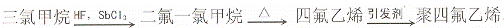
下列说法中,不正确的是
A.“塑料王”不能使酸性高锰酸钾溶液褪色
B.三氯甲炕(CHCl3)可以用甲院与氯气的取代反应来制取
C.四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上
D.二氟一氯甲院 (CHClF2)中所有原子最外层都达到了8电子稳定结构
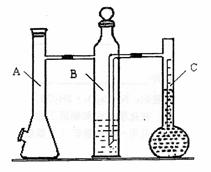 15.利用下图所示实验装置可以测定一条条件下1mol气体的体积,图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线。将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积。
15.利用下图所示实验装置可以测定一条条件下1mol气体的体积,图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线。将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积。
实验步骤(1)装配好化学反应气体体积测定仪,作气密性检查。
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com