
8.用油膜法估测分子的大小
①实验前应预先计算出每滴油酸溶液中纯油酸的实际体积:先了解配好的油酸溶液的浓度,再用量筒和滴管测出每滴溶液的体积,由此算出每滴溶液中纯油酸的体积V。
②油膜面积的测量:油膜形状稳定后,将玻璃板放在浅盘上,将油膜的形状用彩笔画在玻璃板上;将玻璃板放在坐标纸上,以1cm边长的正方形为单位,用四舍五入的方法数出油膜面积的数值S(以cm2为单位)。
③由d=V/S估算出油膜的厚度,即分子直径的大小。
7.用单摆测定重力加速度时,摆长应该是摆线长和摆球半径半径之和;为保证做简谐运动,而不使摆动成为圆锥摆,开始摆动时摆角要小于10º;同时从摆球通过最低点时开始计时,测出单摆做多次全振动所用的时间,算出周期的平均值进行计算。
6.验证机械能守恒定律的原理:物体做自由落体运动,则mgh=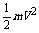 ;实验器材包括:打点计时器,纸带,重锤,米尺,铁架台,烧瓶夹、低压交流电源、导线。本实验由于不必测重锤的质量,故不需要天平.
;实验器材包括:打点计时器,纸带,重锤,米尺,铁架台,烧瓶夹、低压交流电源、导线。本实验由于不必测重锤的质量,故不需要天平.
实验中打点计时器应该竖直固定在铁架台上,必须先合上电源,再松开纸带;且在手释放纸带的瞬间,打点计时器刚好打下一个点子,纸带上最初两点间的距离约为2毫米。由于重锤克服阻力作功,所以动能增加量略小于重力势能减少量,实验为减小误差,重锤应适当大一些。
5.验证动量守恒定律时,为保证到斜槽末端时有相同的速度,每次入射小球都应该从斜槽轨道的同一位置开始自由下滑;为保证碰撞后两小球都向前运动,必须以质量较大的小球作为入射小球;而小球落地点的平均位置要用圆规来确定,即用尽可能小的圆把所有落点都圈在里面,圆心就是落点的平均位置。
4.研究平抛物体的运动的实验原理:用一定的方法描出平抛小球在空中的轨迹曲线,再根据轨迹上某些点的位置坐标,由h=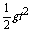 求出t,再由x=v0t求v0,并求v0的平均值。注意:①固定白纸的木板要竖直;②斜槽未端的切线水平,在白纸上准确记下槽口位置;③小球每次从槽上同一位置由静止滑下。
求出t,再由x=v0t求v0,并求v0的平均值。注意:①固定白纸的木板要竖直;②斜槽未端的切线水平,在白纸上准确记下槽口位置;③小球每次从槽上同一位置由静止滑下。
3. 研究匀变速直线运动时,利用打出的纸带可以求被测物体在任一计数点对应时刻的瞬时速度v,且等于以该点为中央时刻的一段运动中的平均速度.加速度则通过“逐差法”计算,如从纸带上得到6个相邻相等时间内的位移时,则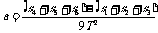 .
.
2. 螺旋测微器读数时,先读取固定部分,这里关键是半刻线,然后读可动部分,此时必须在最小刻度后再估读一位,再把两部分读数相加,即得测量值。而游标卡尺读数时先从主尺上读出与游尺0刻线对应的长度,注意此处不估读,然后看游尺的第几条刻线跟主尺上某一条刻线对齐,则游尺部分的长度即是几十(游尺分度数)分之几毫米,同样二者相加.
1.考试大纲规定的学生实验包括:长度的测量,研究匀变速直线运动,探究弹力和弹簧伸长的关系,验证力的平行四边形定则,验收动量守恒定律,研究平抛物体的运动,验证机械能守恒定律,用单摆测定重力加速度,用油膜法估测分子的大小,测定玻璃的折射率,用双缝干涉测光的波长.
6.(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)===N2O4(g)
△H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
2009-2010学年(下)厦门理工学院附中
5.人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=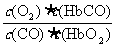
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com