
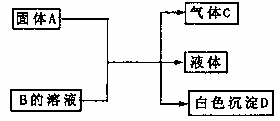
20、(10分)A、B、C、D为中学化学常见的物质,它们间的反应关系如下图所示。
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式 ,有关反应的化学方程式为
。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。 当A是NaHCO3时,该反应的离子方程式为
。
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水。 C的燃烧热为1300kJ/mol。则B的化学式为 :C燃烧的热化学方程式为 。
19、(5分)A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ AI3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- 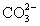 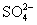 HCO3- HCO3- |

分别取它们的水溶液进行实验,结果如下:
①A溶液分别其他四种溶液反应,均有沉淀;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是A
;B
;C
;D
;E
。
18、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中,湿法制备的主要反应方程为: Fe(OH)3+ClO-+OH-===FeO42-+Cl-+H2O
干法制备的主要反应为:FeSO4+Na2O2==Na2FeO4+Na2O+Na2SO4
+O2↑(均未配平)
下列有关说法不正确的是
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质

2010届同升湖实验学校高三年级第三次月考
化学答卷

第Ⅰ卷

第Ⅱ卷
17、将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为
A.①②③④ B.③④①② C.④③①② D.②①④③
16、将质量分数为98%,密度为1.84的浓硫酸,用蒸馏水稀释到49%的硫酸。则其物质的量浓度
A.大于9.2
B.小于9.2
C.等于9.2
D.不能确定
15、有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
14、某溶液中可能含有I-、 NH4+、 Cu2+、 SO32-,向该溶液中加入足量的溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- 可能含有I-
A.①③
B. ①②③ C. ③④
D. ②③④
13、工业上以氧化钙和硝酸制备四水合硝酸钙Ca(NO3)2·4H2O晶体,为确保制备过程中既不补充水分,也无多余水分,所用硝酸溶液中溶质的质量分数应为
A.70%
B.69.5% C.63.6% D.53.8%
12、下列反应的离子方程式正确的是
A.氢氧化钡溶液与硫酸溶液反应:Ba2+ +SO42- == BaSO4↓
B.镁和浓硫酸反映:Mg + 2H+
== Mg2+ H2↑
C.硝酸银溶液滴人碘化钾溶液中:Ag+ + I-
== AgI↓
D.硫酸镁和氢氧化钠溶液:MgSO4
+ 2OH- == Mg(OH)2↓ + SO42-
11、将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.反应过程中得到6.72L(标准状况)的气体 B.最终得到9.8g的沉淀
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com