
2、可逆反应A(气)+2B(气) nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是…………………(
)
nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是…………………(
)
A、P1>P2 ,n >3 B、P1>P2 ,n <3
C、P1<P2 ,n >3 D、P1<P2 ,n <3
思维方法: 。
展望高考:
1、在密闭容器中充入A、B或G、H进行可逆反应:aA(气)+bA(气) gG(气)+hH(气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是
gG(气)+hH(气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是
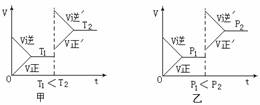
A、开始时充入G和H a+b<g+h Q<0
B、开始时充入G和H a+b<g+h Q>0
C、开始时充入G和H a+b>g+h Q>0
D、开始时充入A和B a+b>g+h Q>0
思维方法: 。
展望高考:
3.外界条件对反应速率的影响是由 决定的;
(1)浓度的影响就是
(2)压强的影响就是 ;
(3)温度的影响就是
(4)催化剂的影响就是
[小结]外界条件对化学反应速率影响的规律(勒沙特列原理)
。
[例题解析]
[例1]在2A + B 3C + 4D反应中,表示该反应速率最快的是( )
3C + 4D反应中,表示该反应速率最快的是( )
A VA = 0.5 mol·L-1·S-1 B VB = 0.3 mol ·L-1·S-1
C VC = 0.8 mol·L-1·S-1
D VD= 1 mol L-1·S-1
解题思路: 。
易错点: 。
[例2] 右图表示800℃ 时A、B、C三种气体物质的浓度随时间变化的情况,t
是到达平衡状态的时间。试回答:
(1) 该反应的反应物是_____________。
(2) 该反应的化学反应方程式为_____________。
(3) 若达到平衡状态的时间是2分钟,A物质的平均反应速率为___________。
解题思路: 。
易错点: 。
[例3] 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
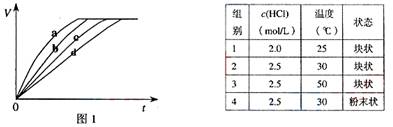
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
解题思路: 。
易错点: 。
[考题再现]
2.活化分子的概念 ;
1. 有效碰撞概念
4、影响反应速率因素:
①浓度 :浓度越大,反应速率越快 ( 不能改变其浓度)
②温度 :温度越高,反应速率越快(注意:正逆反应速率同时增大)
③压强 :增大压强(减小体积),反应速率增大(只适用于 )
④催化剂:加快反应速率;(正逆反应速率同时同倍数增大)
⑤其它条件:例如 等等。
3、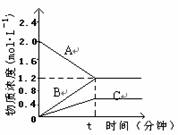 一个重要规律:不同物质的速率的比值等于化学方程式中相应 的系数比。
一个重要规律:不同物质的速率的比值等于化学方程式中相应 的系数比。
如对:mA +
nB  pC +
qD
pC +
qD
有:υ(A)∶υ(B)∶υ(C)∶υ(D)=m∶n∶p∶q
2、特点: (1).是平均速率,均取正值;
(2).方程式中的系数之比等于各物质反应速率之比;
(3).同一反应中用不同的物质表示的速率,其数值可能不同.
1、概念: ;
公式:υ=△C/△t (△C-浓度变化量;△t-反应时间)
单位: ;
18. [解析]根据题给物质,包括Fe2O3,Fe,CuO,C,Al,根据(1)中现象,可知不含Al,Y为亚铁盐溶液,固体为Cu和Fe;Z为一种气体时,浓酸为硫酸,其:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,通过碳酸氢钠后,气体只有CO2, 若是两种气体时,浓酸为硝酸,C+4HNO3=CO2↑+4NO2↑+2H2O,通过水后,气体为CO2和NO;向Y中通入过量氯气,生成的FeCl3逐渐与铁粉和铜粉反应生成CuCl2和FeCl3,溶液阳离子为Cu2+,Fe3+和H+;氯化亚铁溶液中加淀粉碘化钾和H2O2时,其反应为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;原样品中加足量稀硫酸,Y溶液中不出现红色固体,则原样品中不存在铁和铝,故其可能组合为:CuO和C或CuO、C和Fe2O3。
CO2↑+2SO2↑+2H2O,通过碳酸氢钠后,气体只有CO2, 若是两种气体时,浓酸为硝酸,C+4HNO3=CO2↑+4NO2↑+2H2O,通过水后,气体为CO2和NO;向Y中通入过量氯气,生成的FeCl3逐渐与铁粉和铜粉反应生成CuCl2和FeCl3,溶液阳离子为Cu2+,Fe3+和H+;氯化亚铁溶液中加淀粉碘化钾和H2O2时,其反应为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;原样品中加足量稀硫酸,Y溶液中不出现红色固体,则原样品中不存在铁和铝,故其可能组合为:CuO和C或CuO、C和Fe2O3。
[答案]
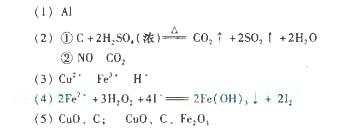
[高考考点]元素化合物知识和有关计算、离子方程式的书写
[易错提醒]不能正确理解通入过量氯气对反应的影响,造成书写的离子不全,离子方程式书写错误。
[备考提示]探究性学习的方法及思维方式,是一种高考的发展方向之一。其往往采用对比的方法,根据实验中出现的不同现象进行合理的解释或阐述,以期展现思维的过程。希望同学们在复习备考中多注意训练,逐步培养自己科学的学习研究素养。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com