
4、原子守恒:+H2O
[练习3](09年广东)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
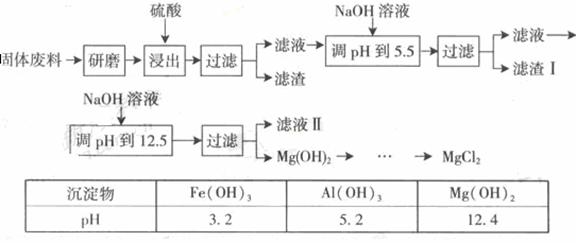
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
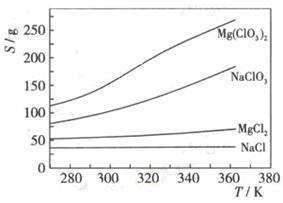
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3===Mg(ClO3)2+2NaCl已知四种化合物的溶解度(S)随温度(T)变化曲线如上图所示:将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
3、电荷守恒:关注溶液酸碱性(+H+或+OH-)
2、电子守恒:配平化合物发生变化的前后物质
1、写:尽可能写出反应物和生成物
5、(08江苏高考)Fe2+和O2反应的离子方程式: 。
Cl2将Fe(OH)3(溶液中有KOH)氧化为K2FeO4的化学方程式:
。
[方法归纳]
书写方程式(化学方程式、离子方程式、电极反应方程式)四步骤:
4、(苏中三市二模)SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
。
3、(南京二模)如右图所示,则阴极的电极反应式 。
2、(淮安二模)镍氢电池(以KOH为电解液)充放电总反应式是:
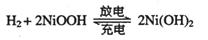
请写正极的电极反应式为_______ __________。
[典例2] (09年江苏改编)
(09年江苏改编) 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的质量分数为97.0%~103.0%)的主要流程如下:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的质量分数为97.0%~103.0%)的主要流程如下:


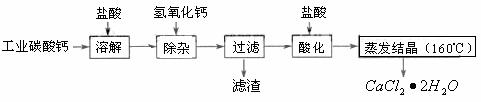
 (1)除杂操作是加入氢氧化钙,调节溶液的
(1)除杂操作是加入氢氧化钙,调节溶液的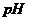 为8.0~8.5,目的是 。检验Fe(OH)3是否沉淀完全的实验操作是 。
为8.0~8.5,目的是 。检验Fe(OH)3是否沉淀完全的实验操作是 。
 (2)酸化操作是加入盐酸,调节溶液的
(2)酸化操作是加入盐酸,调节溶液的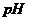 约为4.0,其目的有:① ; ② ;③ 。
约为4.0,其目的有:① ; ② ;③ 。
[解题步骤和方法]
[练习2](09年上海)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

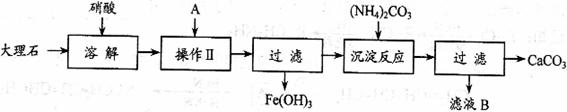
 (1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
(1)溶解大理石时,用硝酸而不同硫酸的原因是_______________________________。
 (2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是___________。
 (3)写出检验滤液中是否含铁离子方程式:____________________________________。
(3)写出检验滤液中是否含铁离子方程式:____________________________________。
 (4)写出加入碳酸铵所发生反应的离子方程式:________________________________。
(4)写出加入碳酸铵所发生反应的离子方程式:________________________________。
 写出滤液B的一种用途:_______________________________。
写出滤液B的一种用途:_______________________________。
[知识存储反馈练习]
1、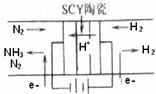 (淮安二模)Fe2+将Cr2O72-转变为Cr3+的离子方程式为_______________________________。
(淮安二模)Fe2+将Cr2O72-转变为Cr3+的离子方程式为_______________________________。
[练习1](2010年苏中三市二模)一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
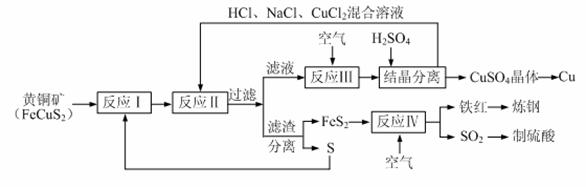
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式) 。
⑵反应Ⅲ的离子方程式为 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com