
3、
2、
1、
[典例1] (09年江苏改编)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(09年江苏改编)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

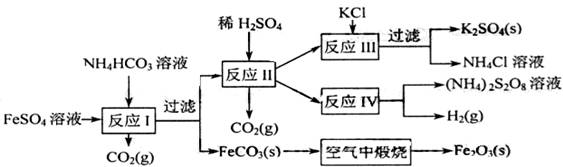
 (1)反应I前需在
(1)反应I前需在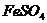 溶液中加入 (填字母),目的是
。
溶液中加入 (填字母),目的是
。
 A.锌粉 B.铁屑
C.KI溶液
D.
A.锌粉 B.铁屑
C.KI溶液
D.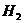
(2)用化学反应方程式表示反应Ⅰ原理: 。
 (3)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(3)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(4)反应Ⅱ中加H2SO4目的是 。
 (5)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(5)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (6)反应Ⅳ常被用于电解生产
(6)反应Ⅳ常被用于电解生产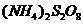 (过二硫酸铵)。电解时均用惰性电极,阳极发生电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生电极反应可表示为
。
(7)FeCO3在空气中煅烧的反应方程式 。
[解题步骤和方法]
29.有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
|
|||||||||
|
|||||||||
|
|
||||||||
|
|||||||||
|

|





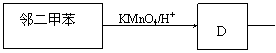
|

|
|

|
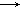

 已知:①RCH=CH2 + CO + H2 ;
已知:①RCH=CH2 + CO + H2 ;
②烃A是有机合成的重要原料。A的的相对分子质量为42,分子中含有碳碳双键;B能发生银镜反应;有机物C分子中含有5种不同的氢原子,且个数之比为3:2:2:2:1;DBP分子中苯环上的一溴取代物只有两种。
(1)A的结构简式是 。
(2)B含有的官能团名称是 。
(3)有机物C和D反应生成DBP的化学方程式是: 。
(4)下列说法正确的是(选填序号字母) 。
a.A能发生聚合反应、加成反应和氧化反应
b.和C互为同分异构体,且含有相同官能团的有机物有2种
c.邻二甲苯能氧化生成D说明有机物分子中基团之间存在相互影响
d.1 mol DBP可与含2 mol NaOH的溶液完全反应
|
|
 ① E
+ C
中间产物 ②中间产物+
C
① E
+ C
中间产物 ②中间产物+
C 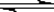 DBP
DBP
|

|
芳香烃X的一溴取代物只有两种,X的的结构简式是: 。
(1)CH3CH=CH2 (2)醛基(写结构简式给分)
(3)

|
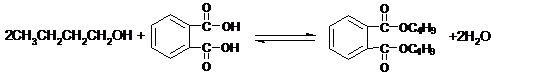
(4)acd (5)减少生成物,使平衡向右移动 (6)
28.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
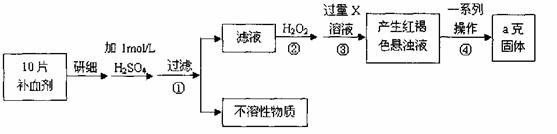
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁,其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含 mg FeSO4·7H2O的片剂。
(1)氯水(或双氧水、稀硝酸等合理氧化剂)溶液由浅绿色变为血红色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-→Fe(OH)3↓(或Fe3++3NH3·H2O→Fe(OH)3+3NH4+)
(4)洗涤、冷却
(5)0.07a
(6)①250mL容量瓶②紫(或紫红)
(7)69.5mg
27.A、B、C均是由短周期元素组成的单质,D、E、F、G、H均为化合物,F在常温常压下为液态,它们有下图所示的转化关系:
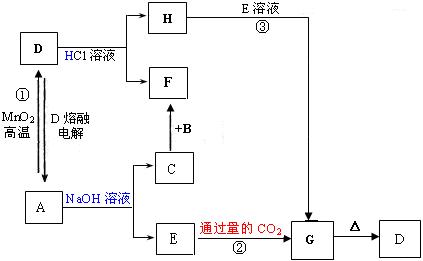
根据以上转换关系回答:
(1)写出D物质在工业上的两种用途
(2)把A的薄箔卷成筒状在氧气中燃烧的现象
(3)写出反应①的化学方程式 ;
(4)写出反应②和③的离子方程式
② ;
③ 。
(5)写出用惰性电极电解H溶液的离子方程式
(1)冶炼金属的原料;做耐火材料(2)剧烈燃烧,放出大量的热和耀眼的白光
(3)4Al+3MnO2 2Al2O3+3Mn (4)②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(CO2过量)
2Al2O3+3Mn (4)②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(CO2过量)
③3AlO2-+Al3++6H2O=4Al(OH)3↓
(5)2Al3++6Cl-+6H20 =2Al(OH)3↓+3H2↑+3Cl2↑
=2Al(OH)3↓+3H2↑+3Cl2↑
26.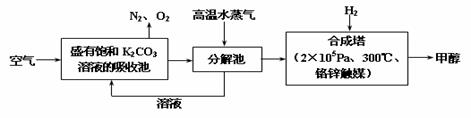 最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)上述流程中碳酸钾溶液所起的作用是: ;
(2)分解池中反应的化学方程式为 ;
(3)在合成塔中,若有4.4 kg CO2与足量H2恰好完全反应,生成气态的水和甲醇气体,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式:
;
(4)从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用300℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 ;
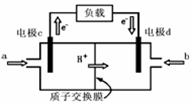
(5)右图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH + 3O2=2CO2 + 4H2O则:a处通进的物质是 (写名称);电极d的名称是 极;电极c处发生的电极反应方程为: 。
(1)富集空气中的CO2,为合成甲醇提供CO2(其余合理答案均给分)
(2)2KHCO3 K2CO3 + CO2↑+ H2O
K2CO3 + CO2↑+ H2O
(3)CO2(g) + 3H2(g)
= CH3OH(g) + H2O(g);ΔH=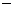 49.47kJ/mol
49.47kJ/mol
(4)保证有较快的反应速率 (能答出与速率相关的正确答案即可给分)
(5)甲醇;正;CH3OH
+ H2O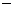 6e
6e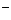 = CO2 + 6H+
= CO2 + 6H+
13.在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,则下列事实或叙述能说明一元酸HA是弱酸的是( )
A.两烧杯中参加反应的锌粒等量
B.反应开始时产生H2的速率相等
C.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大
D.甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大
12.以水为溶剂进行中和滴定的原理是:H3O++OH--→2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l)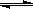 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
A.该滴定反应可以表示为:SO32-
+ SO2+ → 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
A.该滴定反应可以表示为:SO32-
+ SO2+ → 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com