
(三)分子间作用力与物质的性质
1.了解化学键和分子间作用力的区别。
例85.参考下表中物质的熔点,回答下列有关问题
|
物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物质 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点(℃) |
-90.2 |
-70.4 |
5.2 |
120.5 |
-70.4 |
-49.5 |
-36.2 |
-15.0 |
⑴钠的卤化物及碱金属的氯化物的熔点与 有关,随着 增大 减小,故熔点依次降低。
⑵硅的卤化物及硅、锗、锡、铅的氯化物的熔点与 有关,随
着 增大 增大,故熔点依次升高。
⑶钠的卤化物的熔点比相应的硅的卤化物高得多,这与 有关,因为
,故前者熔点远远高于后者。
2.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
例86.关于氢键,下列说法正确的是( )
A、氢键比范德华力强,所以它属于化学键
B、分子间形成的氢键使物质的熔点和沸点升高
C、由于氨与水分子之间可形成分子间氢键,使氨在水中溶解度增大
D、H2O是一种非常稳定的化合物,这是由于氢键所致
3.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
例87A.已知某些晶体的熔点 (见下表):
|
|
NaCl |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
MgO |
|
熔点/℃ |
801 |
1291 |
190 |
107 |
2045 |
-56.6 |
1723 |
2852 |
据此判断下列说法错误的是 ( )
A. 由铝元素组成的晶体中有的是离子晶体
B. 表中所列的物质只有BCl3 和CO2是分子晶体
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氧化物可以形成相同类型的晶体
例87B.将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、铝、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力 ④金属键
正确的顺序是:
A.①②②③④ B.②①②④③ C.②③②④① D.④①①②③
有机化学基础
(二)化学键与物质的性质
1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
例80.NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序是( )
|
物质 |
①NaF |
②NaI |
③MgO |
|
离子电荷数 |
1 |
1 |
2 |
|
键长(10-10m) |
2.31 |
3.18 |
2.10 |
A.①>>②>③ B. ③>①>② C.③>②>① D. ②>①>③
2.了解共价键的主要类型σ型和π型,能用键能、键长、键角等说明简单分子的某些性质。
例81A.在乙烯分子中有5个σ键、一个π键,它们分别是 ( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
例81B.有下列两组命题
|
A组 |
B组 |
|
Ⅰ.H-I键键能大于H-Cl键键能 |
①HI比HCI稳定 |
|
Ⅱ.H-I键键能小于H-C1键键能 |
②HCl比HI稳定 |
|
Ⅲ.HI分子间作用力大于HCl分子间作用力 |
③HI沸点比HCl高 |
|
Ⅳ.HI分子间作用力小于HCl分子间作用力 |
④HI沸点比HCl低 |
B组中命题正确,且能用A组命题加以正确解释的是
A.Ⅰ① B.Ⅱ② C.Ⅲ③ D.Ⅳ④
3.了解简单配合物的成键情况。
例82.(8分)分子(或离子)的空间构型有直线形、角形、平面形、四面体形、三角锥形等。为了解释和预测分子的空间构型,科学家在归纳了已知分子的空间构型的基础上,提出一种简单的理论模型,其理论依据是:分子中的价电子对(包括成键电子对和孤对电子)由于相互排斥作用,而取向彼此远离以减小斥力,分子尽可能采取对称的空间构型。对于ABm形分子(A为中心原子,B为配位原子),分子中的价电子对数(n)可以通过下式确定:
n=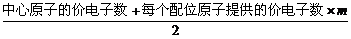
|
分子构型 |
AB2 |
AB3 |
AB2 |
AB3 |
AB4 |
|
价电子对数 |
2 |
3 |
4 |
4 |
4 |
|
几何构型 |
直线形 |
平面形 |
角形 |
三角锥形 |
四面体形 |
说明:①作为配位原子,氧原子、硫原子按不提供价电子计算;
②直线形分子中最少有3个原子,平面形分子中最少有4个原子。
⑴指出下面物质分子或离子的空间构型:
PO43-____________;CS2_____________;AlBr3(共价分子)_______________ 。
⑵有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
 ________________;
________________; ___________________。
___________________。
⑶按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子____________,四面体形分子_____________。
4.了解原子晶体的特征,能描述金钢石、二氧化硅等原子晶体的结构与性质的关系。
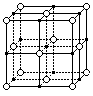 例83.右图为氯化钠晶体中钠离子(·)和氯离子(○)所处的位置(不考虑离子的大小),则在晶体中,
例83.右图为氯化钠晶体中钠离子(·)和氯离子(○)所处的位置(不考虑离子的大小),则在晶体中,
①每一个钠离子周围与它最近的(等距离的)钠离子共有几个?
②若氯化钠晶体的密度位ag/㎝3,晶体中钠离子与氯离子的距离为多少?
5.理解金属键的含义、能用金属键理论解释金属的一些物理性质。
例84.下列说法中正确的是 ( )
A. 金属键的形成是因为金属离子与自由电子之间的相互作用
B. 金属晶体的熔沸点一定比原子晶体的低
C. 金属晶体中金属离子电荷数越多,离子半径越小,金属键就越弱
D. 金属晶体中金属键的强弱与金属原子和自由电子有关
(一)原子结构与元素的性质
1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。了解原子核外电子的运动状态。
例77.某元素的原子序数为24,试回答:
⑴此元素原子的电子总数是多少? ⑵它有多少个电子层?有多少个能级?
⑶它的价电子构型是怎样的?它的价电子数是多少?
⑷它属于第几周期?第几族?主族还是副族? ⑸它有多少个未成对电子?
2.了解元素电离能的含义,并能用以说明元素的某些性质。
例78.不同元素的气态原子失去最外层第1个电子成为+1价阳离子所需要的能量称为第1电离能(E1);+1价阳离子再失去1个电子所需要的能量称为第2电离能(E2)。下表是第二周期元素及钠、钾的第1电离能数据:
|
元素 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
Na |
K |
|
E1(KJ/mol) |
520 |
900 |
801 |
1086 |
1402 |
1314 |
1681 |
2080 |
496 |
419 |
分析表中数据回答下列问题:
(1)同主族不同元素的E1变化规律是 。
(2)同周期内随核电荷数的增加,不同元素的E1值呈逐渐 的趋势,这种趋势体现了元素性质的 变化规律。引起这种变化的原因是 。
(3)从表中数据可判断镁元素的第1电离能数据的最小范围是: < E1(Mg)< 。
(4)氖元素第1电离能较大的原因是 。
(5)锂和铍的第2电离能的关系为:E2(Li) E2(Be)(填>、<、=)
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
例79.2、生活中的下列现象与原子核外电子发生跃迁有关的是( )
A、钢铁长期使用后生锈 B、节日里燃放的焰火
C、金属导线可以导电 D、卫生丸久置后消失
选考内容包括“物质结构与性质”、“有机化学基础”两个部分的内容,考生从中任选一个部分的试题作答。
物质结构与性质
(五)化学实验基础
1.了解化学实验是科学探究过程中的一种重要方法。
例67.学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________。
(2)实验编号3的实验中KClO3的分解率为___________________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用___________________试纸检验。上述异常现象产生的原因是_________________________________。
VI 实验结论:_____________________________________________________________。
2.了解化学实验室中常用仪器的主要用途和使用方法。
例68.(1)下列实验操作中,正确的有 。
①用试管夹夹持试管时,试管夹从试管上部往下套,夹在试管的中上部;
②将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管;
③硝酸、溴水可长期盛放在棕色的滴瓶中;
④熔融氢氧化钠要在耐高温的石英坩埚中;
⑤准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处
⑥检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2-3滴即可。
(2)在仪器①分液漏斗、②集气瓶、③细口试剂瓶、④滴瓶、⑤酸式滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同) 。
3.掌握化学实验的基本操作,能识别化学安全使用标识,了解实验室一般事故的预防和处理方法。
例69.下列实验操作,正确的是( )
①中和滴定时,用标准液润洗滴定管,用待测液润洗移液管和锥形瓶,并在锥形瓶内滴入l mL指示剂
②配制物质的量溶液时,将称量好的溶质溶于盛有适量水的烧杯中,待溶解后立即倾入容量瓶中,继续进行洗涤和定容
③用NaOH溶液和可溶性铝盐溶液大量制取Al(OH)3
④制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再逐渐注入NaOH溶液
⑤蔗糖加稀硫酸水解后,将水解液滴入银氨溶液,水浴加热后即可见银镜
A.①②③ B.②⑤ C.④ D.以上都不正确
附:常见事故的处理方法
|
事故 |
处理方法 |
|
酒精及其它易燃有机物小面积失火
|
立即用湿布扑盖 |
|
钠、磷等失火 |
迅速用砂覆盖 |
|
少量酸(或碱)滴到桌上
|
立即用湿布擦净,再用水冲洗
|
|
较多量酸(或碱)流到桌上
|
立即用适量NaHCO3溶液(或稀HAC)作用,后用水冲洗 |
|
酸沾到皮肤或衣物上
|
用水冲洗,再用NaHCO3稀溶液冲洗 |
|
碱液沾到皮肤上 |
先用较多水冲洗,再用硼酸溶液洗
|
|
酸、碱溅在眼中 |
立即用水反复冲洗,并不断眨眼,千万不要用手揉眼睛。
|
|
苯酚沾到皮肤上 |
用酒精擦洗后用水冲洗
|
|
白磷沾到皮肤上 |
用CuSO4溶液洗伤口,后用稀KMnO4溶液湿敷 |
|
溴滴到皮肤上 |
应立即擦去,再用稀酒精等无毒有机溶济洗去,后涂硼酸、凡士林 |
|
误食重金属盐 |
应立即口服蛋清或生牛奶
|
|
汞滴落在桌上或地上
|
应立即撒上硫粉 |
4.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
例70.某校化学课外小组同学组装了下列仪器,欲经过简单连接,制备中学化学的几种常见气体.
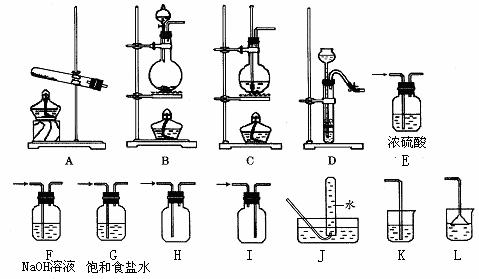
请填写下列表格中的空白处:
|
序号 |
气体 |
装置的连接顺序 (用编号表示) |
按要求填 试剂名称 |
实验室制备该气体的化学方程式 (是离子方程式的只写出离子方程式) |
|
(1) |
CO2 |
制备→收集 |
/ |
|
|
(2) |
NH3 |
制备→收集→尾气处理 |
若干燥氨气可选用的试剂 |
|
|
(3) |
Cl2 |
制备→净化→干燥→收集→尾气处理 |
处理尾气的试剂
|
|
|
(4) |
|
制备→净化→收 集→C→F→J |
/ |
|
5.能对常见物质进行检验、分离和提纯,能根据要求配制溶液。
例71.补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
 ②样品处理
②样品处理
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100mL0.01mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:
、 。
②步骤②脱色过程包括加入: (填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→ (填操作)。
③比色法确定待测液的浓度其原理是
④若其补铁剂是由乳酸(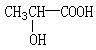 )与铁粉作用生成的,请写出该反应的化学方程式:
)与铁粉作用生成的,请写出该反应的化学方程式:
。
6.能根据实验试题做到:
(1)设计、评价或改进实验方案。
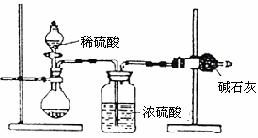 例72.8分)一般测定样品中成分含量的实验应重重2-3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
例72.8分)一般测定样品中成分含量的实验应重重2-3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
Ⅰ.甲同学的方案如右图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行 次;
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能的原因是( )。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足
Ⅱ.乙同学的方案是:称取样品mg,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ;
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是
。
(2)了解控制实验条件的方法。
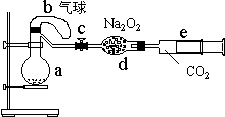 例73.如下图的装置中:a是盛有标况下的空气(氧气占五分之一)和10毫升1.2mol/L硝酸的250毫升烧瓶。b是未充气(实验开始前内部没有气体)放有0.384克铜粉的气球。c是夹紧了的弹簧夹。d中盛有足量的过氧化钠。e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
例73.如下图的装置中:a是盛有标况下的空气(氧气占五分之一)和10毫升1.2mol/L硝酸的250毫升烧瓶。b是未充气(实验开始前内部没有气体)放有0.384克铜粉的气球。c是夹紧了的弹簧夹。d中盛有足量的过氧化钠。e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是 。
(2)欲提高铜与硝酸反应的速度可采用多种不同的措施
①若用加入化学试剂法,下列试剂中可以使用的是(填代号) ;
A 蒸馏水 B 无水醋酸钠 C 石墨 D 硝酸银溶液(少量)
②若用升高温度法,请在图中画出完整的示意图。
③将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是 ,此时气球全在烧瓶外还是有一部分进入烧瓶?
④打开弹簧夹将二氧化碳扒推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳 毫升
⑤将上述全过程用一个总的化学方程式表示。
(3)分析或处理实验数据,得出合理结论。
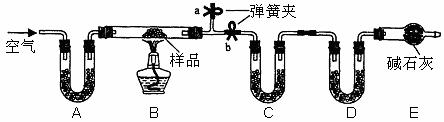
例74.有一含NaCI、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
(1)加热前通入空气的目的是 ,
操作方法为
(2)装置A、C、D中盛放的试剂分别为 A ,C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCI含量将 填(“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量 。
(4)若样品质量为Wg,反应后C、D增加的质量分别为mlg、m2g,由此可知混合物中NaHCO3
质量分数为 。(用含w、mI、m2的代数式表示)
(4)绘制和识别典型的实验仪器装置图。
例75.某绿色粉末的组成可表示为Cu2(OH)2CO3·xH2O,在加热条件下,该粉末在失去结晶水的同时发生分解反应,化学方程式为:Cu2(OH)2CO3·xH2O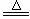 2CuO+CO2↑+(x+1)H2O
2CuO+CO2↑+(x+1)H2O
现取一定量该粉末(未精确测定质量)样品,用下图所列仪器(夹持、加热等仪器均略)先后进行两个实验:(I)测定粉末组成中结晶水的x值;
(Ⅱ)用NH3还原前一个实验的残留固体,可回收其中的金属单质,同时还生成一种无污染的气体
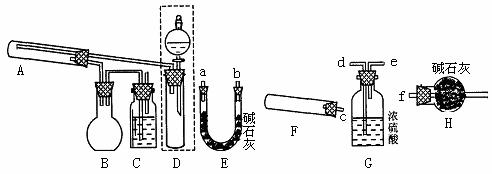
(1)见图中已装配好的一套装置,回答下列问题:
①该装置用于进行实验(选填I或Ⅱ)________,实验时需对A处进行加热,写出A中的反应方程式 _____________________________________________
②虚线框内的仪器可用于快速制取少量的氨气,所用药品为浓氨水、NaOH固体;广口瓶C中盛有蒸馏水,其作用是吸收末反应的NH3,避免对室内环境带来不良的影响。有的同学建议为了简化实验装置,可以去掉烧瓶B,直接将A、C相连,这样做可以吗?说一说你对这一建议的看法是:
 ___________________________、___________________________,
___________________________、___________________________,
有的同学提出可用一个装置代替B、C两个装置,请你在右边虚线框内画出替代装置的装置;
(2)用图中其它仪器组装成另一套实验装置,用来完成另一个实验,则这些仪器按气流从左到右方向的连接,各接口的连接顺序(填写各接口的小写字母):
_→__ _→___ _→_____ →_______ →f。
7.以上各部分知识与技能的综合应用。
例76.某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液
⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
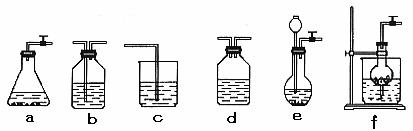
(1)请按下表要求,填写选择的装置和药品。
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:
_______________________________________________________________ ___________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为______________________________,Y装置中除去的杂质为 _____。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其原因是_______ _____________________________________________;通入过量CO2后,Z装置内的溶液中离子浓度大小顺序为____________________________________________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。附:有关物质在常温(20℃)时的溶解度。
|
化学式 |
Na2CO3 |
NaHCO3 |
NaOH |
NaCl |
Na2SO4 |
|
溶解度(g/100g H2O) |
21.3 |
9.60 |
107 |
35.8 |
19.4 |
(四)常见有机物及其应用
1.了解有机化合物中碳的成键特征。
例60.已知某碳氢化合物A的分子中:①有6个碳原子;②每个碳原于都以3个键长相等的单键分别跟其他3个碳原子相连,形成2个90°的碳-碳-碳键角和1个60°的碳-碳-碳键角。根据以上事实判断:
(1)A的化学式为___________。 (2)分于中(填有或无)__________碳碳双键。
(3)A的结构可表示为(只要求画出碳架的空间结构,不必写出C,H的符号)
___________________________。
2.了解甲烷、乙烯、苯等有机化合物的主要性质。
例61.苯与甲烷、乙烯、乙炔相比较,下列叙述中错误的是 ( )
A.苯和甲烷都易发生取代反应
B.苯与乙烯、乙炔都易发生加成反应
C.乙烯和乙炔易发生加成反应,苯只有在特殊条件下才发生加成反应
D.乙烯和乙炔易被氧化剂氧化,苯不易被氧化
3.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
例62.由乙烯和其它无机原料合成环状酯E和高分子化合物H的示意图如下:
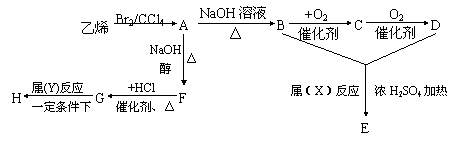
请回答下列问题:
(1)写出结构简式:A ,F ,C 。
(2)反应类型:X 、Y 。
(3)写出化学反应方程式:
B→C 。
G→H 。
(4)若环状酯E在NaOH溶液中共热,则发生反应的化学方程式为:
。
4.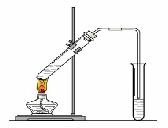 了解乙醇、乙酸的组成和主要性质以及重要应用。
了解乙醇、乙酸的组成和主要性质以及重要应用。
例63.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:
。
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是 。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
5.了解糖、油脂、蛋白质的组成和主要性质以及重要应用。
例64.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A. 植物油不能使溴的四氯化碳溶液褪色 B. 淀粉水解的最终产物是葡萄糖
C. 葡萄糖能发生氧化反应和水解反应 D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
6.了解常见高分子材料的合成及其重要应用。
例65.“智能型”大分子在生物工程中有广泛的应用前景。PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离,下列是以物质A为起始反应物合成PMAA的路线。已知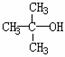 结构相似的醇不能被氧化为醛或酸。
结构相似的醇不能被氧化为醛或酸。
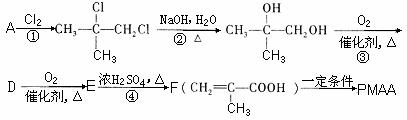
根据上述过程回答下列问题:
(1)写出结构简式:A PMAA 。
(2)写出上述过程中的反应类型:① ④ 。
(3)写出③的化学方程式 。
7.以上各部分知识的综合应用
例66.现有只含C、H、O的化合物A-D,方框内给出了它们的有关信息。
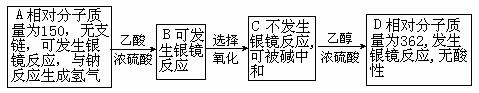
⑴试写出D的分子式 。
⑵试写出A发生银镜反应的化学方程式 。
(三)常见无机物及其应用
1.常见金属元素(如Na、Al、Fe、Cu等)
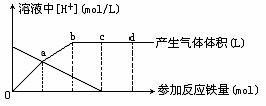 例53.铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知在与冷稀HNO3反应时,主要还原产物为NO气体;在与热的稀HNO3作用时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀HNO3的作用,请分析下图,回答有关问题(假设曲线的各段内只有一种还原产物)。
例53.铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知在与冷稀HNO3反应时,主要还原产物为NO气体;在与热的稀HNO3作用时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀HNO3的作用,请分析下图,回答有关问题(假设曲线的各段内只有一种还原产物)。
(1)0点到a点的还原产物是_ _____;
(2)a点到b点的还原产物是__ ____,其原因是___ _ __;
(3)试完成b点到c点的反应方程式: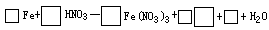
(4)反应过程中,到达___ ___点时HNO3已完全反应。
(5)已知达到d点时,反应结束,此时溶液中的主要阳离子是__ ____;
(6)c点和d点参加反应的铁的物质的量之比是___ ___;
(1)了解常见金属的活动顺序。
例54.根据下列事实: (1) A+B2+=A2++B; (2) D+2H2O=D(OH)2+H2↑; (3) 以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-==E, B-2e-=B2+,由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是:( )
A. D2+>A2+>B2+>E2+ B. A2+>B2+>D2+>E2+ C. D2+>E2+>A2+>B2+ D. E2+>B2+>A2+>D2+
(2)了解常见金属及其重要化合物的主要性质及其应用。
例55.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
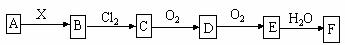
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B..当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
(3)了解合金的概念及其重要应用。
例56.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是( )
|
|
Na |
Cu |
Al |
Fe |
|
熔点 |
97.5℃ |
1083℃ |
660℃ |
1535℃ |
|
沸点 |
883℃ |
2595℃ |
2200℃ |
3000℃ |
A.Cu和Na B.Fe与Cu C.Cu与Al D.Al与Na
2.常见非金属元素(如H、C、N、O、Si、S、Cl等)
(1)了解常见非金属元素单质及其重要化合物主要性质及应用。
例57.当甲无论是强酸还是强碱时,都有如下转化关系。已知D的相对分子量比C的相对分子量大16,E是酸。试回答:
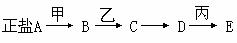
(1) 当甲是强酸时,A、B、C、D、E均含_ ___元素。
(2) 当甲是强碱时,A、B、C、D、E均含_ ___元素。
(3) A是_________;乙是__ ___;丙是___ ____。
(2)了解常见非金属元素单质及其重要化合物对环境质量的影响。
例58.背景材料:①2004年夏季,特氟隆不粘锅事件引起公众关注;②2004年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③2005年初春,广东大部分地区进行人工降雨;④2005年春末,某高速公路发生液氯运输车翻倒泄露事故。下列相应说法正确的是:
A、特氟隆(聚四氟乙烯)的单体是氟利昂
B、蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象
C、AgI和干冰都可用于人工降雨
D、附近人员应迅速远离液氯泄露地点,并逆风往安全区域疏散
3、以上各部分知识的综合应用。
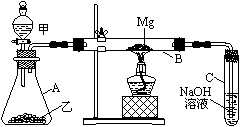 例59.已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
例59.已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
Ⅰ.用如图所示装置进行Mg和SO2的实验。
(1)选择制取SO2的合适试剂____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式_______________________________。装置C中
NaOH溶液的作用是 。
(3)你认为该装置是否有不足之处? 。如果有,请一一说明 。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si
②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(4)该小组“实验室制Si”的化学方程式是_____________________ ______________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是
。
(一)化学科学特点和化学研究基本方法
1.了解化学的主要特点是在原子、分子水平上认识物质。了解化学可以识别、改变和创造分子。
例1.物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
A.①②③⑤ B.①②⑤ C.②⑤⑥ D.①④⑤⑥
2.了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法,认识化学是一门以实验为基础的科学。
例2.向溴水中加入足量乙醛溶液,可以看到溴水褪色。对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(1)方案一是否可行? 。
理由是 。
(2)假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)= mol则说明溴水与乙醛发生取代反应。若测得反应后n(Br-)= mol则说明溴水与乙醛发生加成反应,若测得反应后n(Br-)= mol则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为1∶5配制1000mL KBrO3一KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2。取该溶液10mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀释为100mL,准确量取其中的10mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为 (填序号)。
(4)写出上述测定过程中反应的离子方程式。
①KBrO3与KBr在酸性条件的反应: 。
②溴水与乙醛反应: 。
(5)根据上述信息,试推测向酸性KMnO4溶液中滴加乙醛可能出现的现象。
3.了解物质的组成、结构和性质的关系,了解化学反应的本质、基本原理以及能量变化等规律。
例3.A、B两元素的原子分别获得两个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量.若A、B和C、D分别形成化合物时,属于离子化合物可能性最大的是( )
A.C2A B.C2B C.D2A D.D2B
4.了解定量研究的方法是化学发展为一门科学的重要标志;理解摩尔(mol)是物质的量的基本单位,可用于进行简单的化学计算。
例4.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
v |
下列计算结果正确的是( )
A.硝酸的浓度为4mol/L B.①中溶解了5.6gFe C. ②中溶解了9.6gCu D.④中v=8960
5、了解科学、技术、社会的相互关系(如化学与生活i、材料、能源、环境、生命过程、信息技术的关系等),了解在化工生产中遵循“绿色化学”思想的重要性。
例5.保护环境是每个公民的责任。下列做法:①推广使用无磷洗涤剂②城市生活垃圾分类处理③推广使用一次性筷子④推广使用清洁能源⑤过量使用化肥、农药⑥推广使用无氟冰箱。其中有利于保护环境的是( ) A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
必考内容涵盖“化学1”、”化学2”和“化学反应原理”三个模块的内容。根据化学的学科体系和学科特点,必考部分的内容包括以下五个方面;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com