
47.A、B、C、D均为短周期元素,原子序数依次增大。已知:
①A与D同主族,A形成的氢化物分子M与D形成的氢化物分子N都含有18个电子;
②一定条件下,A、D分别和B形成的化合物X和Y具有相同的摩尔质量,且焰色反应均呈黄色;
③A和C形成的化合物Z可形成原子晶体。
请回答下列问题:
(1)X的电子式为_____________;Z的化学式为______________。
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为: _______________________________________________(用元素符号表示)。
(3)化合物Y的水溶液pH>7,用离子方程式说明原因: 。
(4)在M的溶液中通入N,可发生反应生成D的单质和A的另一种氢化物,试写出化学方程式____________________________________________________。
[猜题理由]近年来高考理综化学中的元素推断题有与元素化合物知识结合推断的趋势。按照这种命题趋势命制,以达到高考要求的水平。
46.建筑内墙涂料以聚乙烯醇( )为基料渗入滑石粉等而制成,聚乙烯醇可由下列途径合成。
)为基料渗入滑石粉等而制成,聚乙烯醇可由下列途径合成。
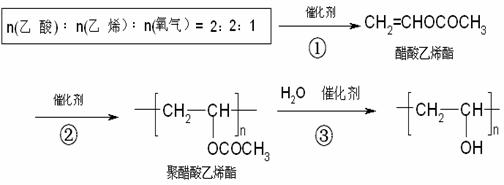
试回答下列问题:
(1)醋酸乙烯酯中所含官能团的名称__________________(只写两种)。
(2)上述反应中原子利用率最高的反应是______________(填序号)。
(3)可以循环使用的原料是___________(写结构简式)。
(4)反应③可看作________________反应(填反应类型)。
[猜题理由]有机合成是高考中的重点,能综合考查学生对该有机基础知识掌握情况,如多官能团名称、性质、有机反应类型、结构简式等,这类题的考查特点是注重知识的广度,是高考的热点。
45.现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
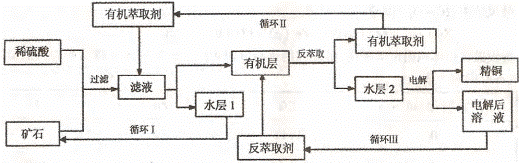
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O、
、 。(写出其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个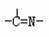 三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
。
三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 。
(5)该工艺最大亮点是它符合下列原理 (填字母,下同)。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。
A.两种方案 B.三种方案 C.四种方案 D.五种方案
[猜题理由]本题以“酸浸法从矿石中提取铜”为载体,考查学生对化学的环境价值、有机物化学键的计算、离子反应方程式书写、电化学中极反应式的书写、Cu、Fe及其化合物等知识的掌握情况,以及应用相关知识解决实际问题的能力,具有较强的综合性。
内容领域:化学基本概念、基础理论和元素化合物
44.随着流感季节的到来和N1H1的威胁,疫苗的需求空前高涨。尽管那些疫苗是有效的,但美国密苏里州大学研究人员于2009年12月研究发现,一些非处方药,如阿司匹林等抑制某些酶的药物会影响疫苗的效果。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。
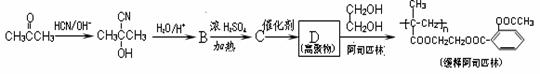
回答下列问题:
Ⅰ.(1)上述合成C的路线曾用作有机玻璃单体(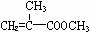 )合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得
)合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得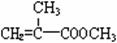 ,其化学方程式为:
。
,其化学方程式为:
。
如此改进的优点为: 。
(2)阿司匹林的结构简式为 ,下列物质与阿司匹林互为同分异构体的有 (填字母)。
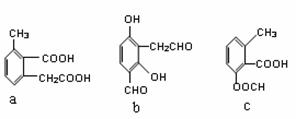
Ⅱ.某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定阿司匹林的纯度(假设杂质不参加反应),进行了下列实验探究:
(1)阿司匹林有效成分中羧基和酯基官能团的验证
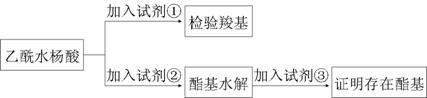
试剂①是________,现象为_________;该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
(2)准确称取阿司匹林a g,粉碎并装入锥形瓶,加水溶解,加入标准浓度C1mol/L的氢氧化钠溶液V1mL,煮沸片刻,使其充分反应。冷却后,用酚酞作指示剂,用C2mol/L盐酸滴定,滴定前盐酸体积为V2mL,滴定终点时盐酸体积为V3mL。(已知:滴定反应是,NaOH+HCl=NaCl+H2O,乙酰水杨酸的相对分子质量为180)
①根据上述数据计算该阿司匹林的纯度为 。
②滴定终点判断“标准”是 ;操作过程中在锥形瓶底垫一张白纸,其作用是 。
③下列操作一定会导致测定结果偏高的是 (填字母)。
A.装盐酸前,滴定管未用标准溶液润洗
B.测定盐酸体积时开始仰视读数,最后俯视读数
C.锥形瓶用标准氢氧化钠溶液润洗
D.滴定过程中盐酸溅到瓶外
E.称量样品时,砝码在左边,而样品放在右边
F.用甲基橙代替酚酞作指示剂
[猜题理由]有机合成和有机推断是化学高考试题中的重点,将知识点与时事等信息联系考查是近些年的主要体现方式,定量实验是实验的难点,也是高考的热点,对能力的要求非常高,而本题就是将有机合成、定量测定融于一体考查有机化学与无机实验融合能力。本题易错点有:(1)易忽视酚酞指示剂作用下滴定原理,如果考虑酚钠和羧酸钠与盐酸反应必然导致错解;(2)问题(4)中“一定”使测定结果偏高,会错选E。(3)误差分析应根据计算式,若简单类比酸碱中和反应,会得出相反结论。
43.某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
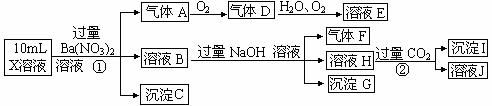
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子(Q)是___________,若要确定该Q(若不止一种,可任选一种)不存在,最可靠的化学方法是_______________________。
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A_______________________________________。
②_______________________________________________。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________
[猜题理由] 限定范围内的离子推断一起备受高考命题专家的青睐,本题将离子的定性推断、定量假设性分析、实验方案设计结合起来,很好地通过考查学生对中学化学中几种极为重要离子性质掌握的情况,同时也能很好地考查学生推理能力、发散思维能力及对电中性这一基本原理的理解与应用。
42.醛在一定条件下可以两分子加成: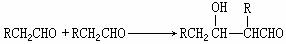
加成产物不稳定,受热即脱水而生成不饱和醛: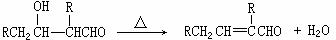
已知物质B是一种可作为药物的芳香族化合物,请根据下图(所有无机产物已略去)中各有机物的转化关系回答问题:
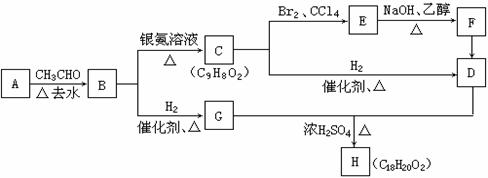
(1)写出B、F的结构简式B:_______________;F:_________________。
(2)物质A的核磁共振氢谱有 个峰,与B具有相同官能团的同分异构体有 种。
(3)图中涉及的有机反应类型有以下的(填写序号)________________。
①取代反应 ②加成反应 ③氧化反应 ④还原反应
⑤消去反应 ⑥聚合反应 ⑦酯化反应 ⑧水解反应
(4)写出G与D反应生成H的化学方程式
_________________________________________________________________。
(5)F若与H2发生加反应,1 mol F最多消耗的H2的物质的量为_________mol。
[猜题理由]有机推断题是高考必考题型。该题综合性较强。
41.(18分)有机物A、D均是重要的有机合成中间体,D被称为佳味醇(chavicol),具有特殊芳香的液体,也可直接作农药使用。下图所示的是由苯酚为原料合成A、D的流程。

已知:
①
②
③请回答下列问题:
(1)写出A、C的结构简式________________、__________________。
(2) 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有_____种氢处于不同的化学环境。
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有_____种氢处于不同的化学环境。
(3)指出A→ 的有机反应类型_________________。
的有机反应类型_________________。
(4)写出符合下列要求的化合物D的所有同分异构体的结构简式___________________。
①遇FeCl3溶液呈紫色;
②苯环上有两个取代基,且苯环上的一氯代物有两种。
(5)化合物B经过下列转化,可合成用于制造树脂、合成橡胶乳液的有机原料丙烯酸。

①设置反应②、⑥的目的是__________________________。
②写出反应③的化学反应方程式______________________________________。
③G与甲醇反应生成的酯H是生产丙烯酸树脂的一种重要单体,写出H聚合的化学反应方程式_________________________________。
[猜题理由]涉及有机化学基础与必修有机化学内容的有机推断题,是浙江省实施新课程后高考方案中不同于其他省市的一个重要题型。从2009年的试题及2010年的考试说明分析,在2010年的浙江卷中,将仍然保持原理科综合试题中对有机化学内容的考查方式,有变化的将是一些新增的知识,如有机结构的物理测定方法、有机物的分离与提纯手段等。本题的制作以有机合成中的两种重要中间体对溴苯酚与对丙烯基苯酚为核心展开,考查了考生书写有机物结构简式、判断有机物结构特征、分析有机物同分异构体及书写相应有机反应方程式的能力,同时,也考察了考生的信息获取、分析、处理、应用的能力,与浙江的有机试题具有极强的相似与仿真度。
40.(14分)锂电池技术是新能源汽车的核心技术。下面是锂电池工作原理示意图:
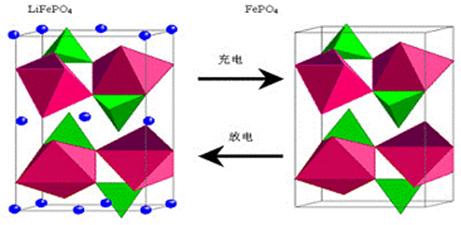

左边是橄榄石结构的LiFePO4作为电池的正极,由铝箔与电池正极连接,中间是聚合物的隔膜,它把正极与负极隔开,Li+可以自由通过而 电子e-不能通过,右边是由石墨和Li组成的电池负极,由铜箔与电池的负极连接。电池的上下端之间是电池的电解质,电解质通常是LiClO4、LiAlCl4、LiAsF4等锂盐,溶剂通常用环脂、直链脂及酰胺等有机溶剂和一些非水无机溶剂。电池由金属外壳密闭封装。
请回答下列问题:
(1)锂电池比容量特别大的原因是: 。
(2)锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因: 。
(3)某锂电池的电池反应方程式是Li+MnO2=LiMnO2。下列有关说法错误的是_________(填字母,下同)。
A.它的负极是锂
B.MnO2在电极反应中被还原
C.当有3.01×1023 个电子转移时,正极消耗1mol MnO2
D.配制锂电池中的电解质溶液可用直链脂等有机物作溶剂
(4)另有一种锂电池是将四氯铝锂溶解在亚硫酰氯(SOCl2)中作电解质溶液,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S
已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水氯化铝AlCl3,则下列叙述正确的是____________。
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出的S的物质的量之比为4:1
[猜题理由]化学高考试题中的信息题常常和时事联系很紧密。2009年末至2010年初,全世界的目光聚集丹麦首都哥本哈根 ,联合国气候变化大会在此召开。来自192个国家的代表一起商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议。这是继《京都议定书》后又一具有划时代意义的全球气候协议书 。
这次会议被喻为“拯救人类的最后一次机会”。会议的中心议题是全世界如何实现“节能减排”。如何实现节能减排,全世界的目光又落在了我们中国的身上。因为以中国为代表的“金砖四国”是世界经济的主要增长点,同时自然也是温室气体排放增长最多的国家。
作为敢于担当的中国人,我们响亮地提出:到2020年,我们将比2005年减少排放CO245%-50%。这一庄严的承诺,赢得全世界掌声一片。
我国为了顺利实现节能减排,就必须调整我国的产业结构,其中重要的一项就是大力发展新能源汽车,而开发新能源汽车的核心技术就是开发高能锂电池。所以有关锂电池的考查应当是今年高考的一个热点。
39.
 a.相同条件下卤化银的Ksp按AgCl、AgBr、AgI 的顺序依次增大
a.相同条件下卤化银的Ksp按AgCl、AgBr、AgI 的顺序依次增大
 b.卤化氢溶入水的酸性按HF、HCl、HBr、HI的顺序依次减弱
b.卤化氢溶入水的酸性按HF、HCl、HBr、HI的顺序依次减弱
 c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
 d.卤素单质氧化性按F2、Cl2、Br2、I2的顺序依次减弱
d.卤素单质氧化性按F2、Cl2、Br2、I2的顺序依次减弱
 (6)卤化氢的键能与键长大小如下表。
(6)卤化氢的键能与键长大小如下表。
|
|
HF |
HCl |
HBr |
HI |
|
键能/kJ·mol-1 |
568.6 |
431.8 |
365.7 |
298.7 |
|
键长/pm |
92 |
127.6 |
141.0 |
162 |
由上表数据可以推断:
 ①卤素单质非金属性越强,与氢化合生成的氢化物越 (填“稳定”或“不稳定”)。
①卤素单质非金属性越强,与氢化合生成的氢化物越 (填“稳定”或“不稳定”)。
 ②卤化氢的键长与卤离子的半径的关系是:
。
②卤化氢的键长与卤离子的半径的关系是:
。
[猜题理由]本题以大学有机化学中烷烃氯化的自由基反应机理:链引发、链增长、链终止三个阶段为为载体,起点高,落点低,主要涉及选修模块3“物质结构”的“原子结构和元素的性质”“化学建与物质的性质”、必修2的“元素周期律”、模块4“化学原理”等内容,具体落实在电子式的书写、共价键类型、电负性大小比较、元素周期表、元素性质递变规律、物质的性质与共价键参数的关系、反应热、难溶物质的浓度积等知识点上。推理是本题的主要立意,要求考生根据已有的知识和题目给定的事实、数据和条件,提取、归纳相关信息,对化学问题进行逻辑推理和论证,得出正确的结论或作出正确的判断,并能把推理过程准确地表达出来。其中大部分知识点为安徽省2010年考试说明新增考点,必然在当年考试中有所体现,希引起广大考生重视。
38.下图所示物质中,只有X是单质,常温下A和B呈气态,且B是导致酸雨的大气污染物,D是淡黄色固体。
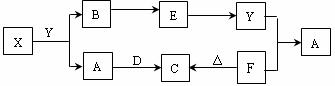
据此回答下列问题:
(1)元素X在元素周期表中位于 周期 族。
(2)物质D的电子式为 ,其阴阳离子个数比为 。
(3)请列举物质F的两种用途: 、 。
(4)写出X和Y反应的化学方程式 ;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为 。
(5)请写出Y和F反应的离子方程式 。
[猜题理由]随着全球气候大会的召开,在近期各地一模和二模的试题中,和气候有关的试题越来越多,本题是结合SO2对大气的危害和重要的化工反应、中学重要化学反应,并结合生活实际的一道无机推断题。考查的知识面比较广,试题综合性强。符合高考命题要求,是一道比价理想的试题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com