
15、 下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是 ( )
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是 ( )
A.2SO2 (g)+O2 (g) 2SO3 (g) ;△H<0
B.4NH3 (g)+5O2 (g) 4NO(g)+6H2O (g) ;△H<0
C.H2 (g)+I2 (g) 2HI (g) ;△H>0
D.C (s)+H2O (g) CO (g)+H2 (g) ;△H>0
14、强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(1);ΔH =-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应ΔH 1、ΔH 2、ΔH 3的关系正确的是 ( )
A.ΔH 1>ΔH 2>ΔH 3 B.ΔH 1<ΔH 3<ΔH 2
C.ΔH 1<ΔH 2<ΔH 3 D.ΔH 1>ΔH 3>ΔH 2
13. 四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:① v(A)= 0.15mol/(L·s)②v(B)= 0.6mol/(L·s) ③v(C)= 0.4mol/(L·s)
④v(D)= 0.45mol/(L·s)。其中,反应进行得最快的是 ( )
A.① B.② C.③ D.④
12.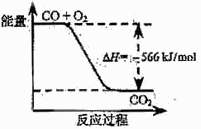 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
11.相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3
C. Q3> Q2> Q1 D. Q1=Q2=Q3
10.
在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是( )
A. SO2为0.4mol/L,O2为0.2mol/L B. SO2为0.4mol/L
C. SO2,SO3均为0.15mol/L D. SO3为0.25mol/L
9. 下列事实中,不能用勒夏特列原理来解释的是( )
A. 加入催化剂有利于氨的氧化反应
B. 氢硫酸中加碱有利于S2-离子的增多
C. 在100℃左右比在室温更有利于FeCl3的水解
D. 高压条件更有利于合成氨反应
8.已知热化学方程式:SO2(g)+ 1/2O2(g) SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
A.196.64kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
7.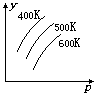 图中表示外界条件(t、p)的变化对下列可逆反应的影响:
图中表示外界条件(t、p)的变化对下列可逆反应的影响:
L(s)+G(g)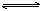 2R(g);△H>0,y 轴表示的是 ( )
2R(g);△H>0,y 轴表示的是 ( )
A. 平衡时,混合气中G的百分含量 B. G的转化率
C. 平衡时,混合气中R的百分含量 D. L的转化率
6.甲乙两容器中发生相同的反应: A(g) + 3B(g) 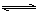 2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
2C(g) ,甲恒容、乙恒压,温度相同而恒定。起始时甲中加入0.01mol A和0.03mol B,乙中加入0.02molC,开始时两容器压强相等,最后分别达到平衡。下列有关它们平衡状态的叙述正确的是( )
A.体积:甲可能小于乙 B.C的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.A、C浓度比值c(A)/c(C):甲一定小于乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com