
17.现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加amol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为 mol
mol
③反应过程中转移的电子数为 mol
mol
④生成NO气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为( )mol
)mol
A.2项 B.3项 C.4项 D.5项
[猜题理由]2010年考试大纲要求:将化学问题抽象成为数学问题,通过计算和推理(结合化学知识),解决化学问题的能力。本题结合铝镁与硝酸反应,生成的盐与氢氧化钠反应的特点,综合考查学生的得失电子守恒,溶液电中性原理、质量守恒的综合计算能力,考虑到现在学生的实际能力水平,题目以多项说法的形式呈现,同时也考查了学生的学习综合能力,总之这是一道考查能力的好题。
16.下列叙述的实验能达到预期目的的是:
|
选项 |
实验内容 |
实验目的 |
|
A |
将含有HCl杂质的CO2通入饱和Na2CO3溶液中 |
除去CO2中的HCl |
|
B |
向少量火柴头的浸泡液中滴加AgNO3、稀HNO3和NaNO2 |
验证火柴头含有硫元素 |
|
C |
市售阿司匹林药品研碎后加蒸馏水溶解,滴加1-2滴1%的氯化铁溶液 |
水杨酸杂质的鉴别 |
|
D |
分别向2支试管中加入相同体积不同浓度的Na2S2O3溶液,再向其中分别加入不同浓度的H2SO4溶液 |
研究反应物浓度对化学反应速率的影响 |
[猜题理由]新教材实验试题形式特点:以图表的形式考查学生实验知识的掌握情况。本题结合浙江省2010年《考试说明》“能根据具体情况设计解决化学问题的实验方案,并能对设计的实验方案进行分析、比较、优化和改进。” 以表格形式评析目的与操作之间的关联性。学生在对实验设计、实验操作及目的性“知其所以然”的情况下才能顺利答题。此题难度:0.65左右。
15.下列操作会使H2O的电离平衡向电离方向移动,且pH<7的是
A.向水中加少量Na2CO3 B.向水中加少量FeCl3
C.向水中加少量NaHSO4 D.将纯水加热到90℃
[猜题理由]本题考查的是弱电解质的电离平衡。解题关键是熟练运用影响电离平衡的因素
14.

13.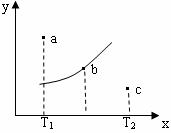 有一反应:2A+B
有一反应:2A+B 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示时间,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示时间,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
[猜题理由]化学平衡中图像问题能很好的考查出学生的分析问题解决问题的能力。
12.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是( )
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以Al(OH)3的形式存在
[猜题理由]电解是电化学知识的主要组成部分,而放电顺序和电子守恒又是电解的重点和难点,另外,电子守恒更是整个高中化学计算的基本思想,能考查学生的思维能力。
11.下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C. 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
[猜题理由]从近年来高考有关化学实验题的命题方向看,命题更加注重考查学生实际操作能力、思维能力和文字表达能力,而物质除杂是一种最基本的题型之一。
10.下列常见有机物中,既能发生取代反应,又能使溴水褪色的是( )
A.甲烷 B.苯 C.CH2=CHCH2OH D.乙酸
[猜题理由]在近几年的宁夏卷中都有1-2个小题考查必修课中常见有机物的结构与性质,本题围绕必修课中常见的有机化合物和常见官能团命题,符合考纲要求,能够考查考生对常见有机物结构和性质的理解。
9.下列关于糖类、油脂、蛋白质的说法中正确的是
A.馒头、米饭在口腔内越嚼越甜,是因为它们含有的淀粉发生了酯化反应
B.糖类、油脂、蛋白质都能发生水解反应
C.豆油、牛油、花生油属于酯类
D.葡萄糖分子结构中只有一个醛基,所以是单糖
[猜题理由]糖类、油脂、蛋白质是与生活相联系最密切的有机物,也是高考的一个高频考点,考查是一些基础知识,预测2010年高考也会考查其基本知识。
8.加热条件下,将24g CuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到澄清石灰水中,得到白色沉淀40g。下列有关叙述中不正确的是( )
A.原混合物中CuO与Fe2O3物质的量的比为l︰l
B.反应后所得CO2的质量为40g
C.参加反应的CO的质量为11.2g
D.原混合物中CuO与Fe2O3的质量比为1︰2
[猜题理由]遵循质量守恒定律是化学反应的基本特点,其具体应用为原子守恒。通过分析物质的组成运用原子守恒进行有关计算,是学生必备的能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com