
5.给出下列结论,其中正确的是 ( )
A.如果向量 ,
, ,
, 共面,向量
共面,向量 ,
, ,
, 也共面,则向量
也共面,则向量 ,
, ,
, ,
, 共面;
共面;
B.已知直线a的方向向量 与平面
与平面 ,若
,若 ∥平面
∥平面 ,则直线
,则直线 ∥平面
∥平面 ;
;
C.若 共面,则存在唯一实数
共面,则存在唯一实数 使
使
D.空间任意不共面四点 ,若
,若 (其中
(其中 ),则
),则 四点共面
四点共面
4.条件甲:“ ”,条件乙:“方程
”,条件乙:“方程 表示双曲线”,那么甲是乙的( )
表示双曲线”,那么甲是乙的( )
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.既不充分也不必要条件
3.若椭圆的一个顶点与两个焦点构成等边三角形,则椭圆的离心率是 ( )
A. B.
B. C.
C. D.
D.
2.到两坐标轴的距离之和等于2的点的轨迹方程是 ( )
A. B.
B. C.
C. D.
D.
1.已知 、
、 ,则线段AB的中点P的坐标为
( )
,则线段AB的中点P的坐标为
( )
A. B.
B. C.
C. D.
D.
28、(共6分,每空2分)铜是日常生活中常见的金属。已知铜的原子序数为29。回答问题:
(1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。
(2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
(3)写出你所设计装置中的化学反应的方程式 。
27. (共6分,每空1分)用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示。
|
实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
|
1 |
25.00 |
26.40 |
|
2 |
25.00 |
24.38 |
|
3 |
25.00 |
24.42 |
试回答下列问题:
(1)使用酚酞做指示剂,滴定过程中两眼应该注视_________________,滴定终点的判断是 。
(2)实验中,指示剂加2滴不能多加是因为:
(3)未知浓度的NaOH溶液的物质的量浓度为 mol/L。(精确到0.0001)
(4)有下列错误操作:
①酸式滴定管用蒸馏水洗净后,未经标准溶液润洗就注入标准的盐酸溶液
②用碱式滴定管取用待测液前,尖嘴部分有气泡,取用过程中气泡消失
③滴定前,读取酸液体积时视线低于酸式滴定管的液面,滴定后读出酸液的体积时,
视线高于酸式滴定管的液面
④锥形瓶用待测液润洗两次
哪些错误操作会使NaOH浓度的测定值偏低?答:_____________。
哪些错误操作会使NaOH浓度的测定值偏高?答:_____________
26.(共12分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d 都是石墨电极。通电一段时间后,在c、d有气体产生,两极上共收集到336mL(标准状态)气体。回答:
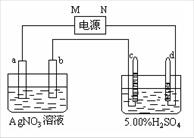 (1)直流电源中,M为 极。(1分)
(1)直流电源中,M为 极。(1分)
(2)Pt电极上生成的物质是 ,
其质量为 __g。(1分+2分)
(3)电源输出的电子的物质的量与电极
b、c、d分别生成的物质的物质的量
之比为:2∶ ∶ ∶ 。(2分)
(4)AgNO3溶液的浓度 (填“增大”、“减小”或“不变”。下同),AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH _。(每空1分)
(5)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液质量为 g。(2分)
25.(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示): ; ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
 AgCl(S) Ag+(aq)+
Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
AgCl(S) Ag+(aq)+
Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1
24.(共6分,每空2分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应2 SO2 (g) + O2 (g) 2 SO3(g) 。
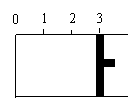 (1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为____ ____。
(1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为____ ____。
(2) 若开始时,充入容器的起始物质分别是
①2 L SO2 和1 L O2 ;
②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是 (用序号和“<”、“=”、“>”表示)。
(3) 向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。
写出SO2 发生氧化反应的热化学方程式:________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com