
2.下表为黄豆和玉米种子中4类有机物的元素组成及含量表(单位:g/100g)。分析表中信息可推知,种子细胞中
 有机物 有机物种子 |
甲(C、H、O、N) |
乙(C、H、O) |
丙(C、H、O) |
丁(C、H、O、N、P) |
|
黄豆 |
35.1 |
8.6 |
18.6 |
0.82 |
|
玉米 |
8.1 |
69.6 |
3.3 |
0.32 |
A.丁只分布在细胞核中
B.丙构成细胞膜的基本支架
C.丁的合成需要甲的参与
D.甲、乙、丁都是由单体连接而成的多聚体
1.研究表明,长期忧虑会使进入循环的T细胞数量下降,进而导致机体
A.细胞免疫和体液免疫功能下降
B.容易产生过敏反应
C.患获得性免疫缺陷病
D.在抗原入侵后不能产生抗体
36.[化学--选修有机化学基础](15分)
已知:
ⅰ.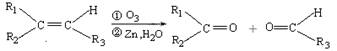 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
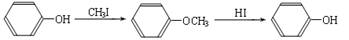
ⅱ.
某种芳香族化合物A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。
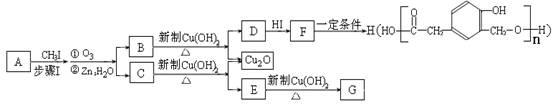 请回答:
请回答:
(1)① F→H的反应类型是 ;气体G的相对分子质量是44,则E的结构简式是 ;
②步骤Ⅰ的目的是 ;
③A的结构简式是 ;上述转化中B→D的化学方程式是 。
(2)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③ 在通常情况下,1molN只能与含1molBr2的浓溴水发生取代反应;
④ N分子中苯环上仅有三个取代基且取代基上无支链。
请问符合上述要求N的同分异构体有 种
35.[化学-选修物质结构与性质](15分)
第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。
(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子核外电子排布式_______________。
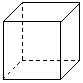 (2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,右图
(2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,右图
正方体是Pt晶胞示意图,叙述Pt原子在晶胞中位置:
__________________________ 。
(3)已知XeO3分子中氙原子上有1对孤对电子,则XeO3
为____________分子(填“极性”或“非极性”);XeO3分
子中中心原子的杂化类型为 ;XeO3分子实际空间构型为
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是
28.(15分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:
CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”=。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平
后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
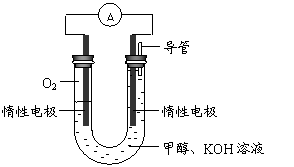
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
26.(14分)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
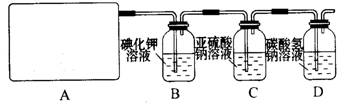
试回答:
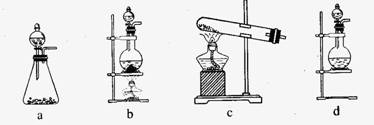
(1)该实验中A部分的装置是 (填写装置的序号)。七彩教育网
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
27.(14分)
A.B.C.D.E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:

(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是 ;工业上冶炼A的化学反应方程式是 。
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是 ;1 mol C完全燃烧生成液态水时放热1300 kJ·mol-1,则C完全燃烧的热化学方程式是 。A与盐B的溶液反应时只生成气体C.碳酸钙沉淀和水,则B的化学式是 。
13.在体积、温度都相同的条件下有下列反应:2A(g)+2B(g)C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A.B的起始物质的量均为2mol,Ⅱ.C.D的起始物质的量分别为2mol和6mol。以下叙述中不正确的是 ( )
A.Ⅰ、Ⅱ两途径达到平衡时,两者对应的各组分的体积分数相同
B.Ⅰ、Ⅱ两途径达到平衡时,两者混合气的平均相对分子质量相同
C.达平衡时,Ⅰ途径所得混合气的密度为Ⅱ途径所得混合气密度的1/2
D.达平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vA
12.下列叙述中,不正确的是 ( )
A.0.1 mol•L-1 CH3COOH溶液加水稀释,n(H+)增大
B.0.2 mol•L-1盐酸与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,溶液pH为1
C.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则
c(NH4HSO4) < c(NH4NO3) < c(NH4HCO3)
11.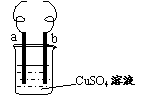 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是
A.构成原电池时b极反应为: Cu﹣2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b 极质量可能减少也可能增加
D.构成的原电池或电解池工作后就可能产生大量气体
10.短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外
层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
( )
A.气态氢化物的稳定性:Z < Y < X B.最高价氧化物水化物酸性:Z > Y
C.原子半径:Z < Y < X D.元素非金属性:Z> Y > X
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com