
27.(4分)A和B两种有机物,各取0.1mol 充分燃烧,都生成4.48L CO2(标准状况)和3.6g H2O。已知A对氢气的相对密度为14,B中碳元素的质量分数为40%,且B的水溶液具有导电性。试求A和B的分子式,并写出它们的结构简式
26.(6分)某有机物A 的分子式为C4H10O,且1molA能与足量金属钠反应生成0.5mol H2(标准状况),
(1)试写出A可能的结构简式
(2)任选一种结构写出在铜作催化剂加热条件下的氧化反应方程式
25.(14分)实验室用如图所示的装置制取乙酸乙酯.

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是: ,然后轻轻振荡试管,使之混合均匀。(2分)
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是_______________________________。
(3)浓硫酸的作用是①___________; ②___________.
(4)饱和Na2CO3溶液的作用是_______________;_________________; _____________________________。
(5)生成的乙酸乙酯的化学方程式 ,(2分)乙酸乙酯的密度比水________(填“大”或“小”),有_________味.
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
24.(11分)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
 ①写出H2O2在二氧化锰作用下发生反应的化学方程式
。(2分)
②实验时放出气体的总体积是 mL。
③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为
min。
①写出H2O2在二氧化锰作用下发生反应的化学方程式
。(2分)
②实验时放出气体的总体积是 mL。
③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为
min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。(2分)
⑥解释反应速率变化的原因 。(2分) ⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)(2分)
23. (7分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为
。(2分)
(3)电极表面镀铂粉的原因为
(2分)
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(7分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为
。(2分)
(3)电极表面镀铂粉的原因为
(2分)
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
22.(8分)有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。纯E为无色油状液体,稀释时能放出大量热;B、C、D和F是盐溶液,且它们的阴离子均不同,现进行如下实验:
①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白烟;
②将A分别加入其它五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶解。根据上述实验信息,请回答下列问题:
⑴ 能确定的溶液是(写出溶液标号与相应溶质的化学式)(4分)
⑵ 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法(4分)
21.(11分)下图所涉及的物质均为中学化学中的常见物质,其中C为气体单质一种主要成分、D在常温下是黄绿色气体、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式
F ,G ,H 。
(2)指出MnO2在相关反应中的作用,反应①中是 剂,反应②中是
剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A的电子式为 。
(4)写出B与MnO2共热获得D的离子方程式
。
(5)写出B与F反应的化学方程式 。
20.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是
A、18O只存在于乙酸乙酯中
B、18O存在于水、乙酸、乙醇以及乙酸乙酯中 C、18O存在于乙酸乙酯、乙醇中
D、若与丙酸反应生成的酯的相对分子质量为102
长春外国语学校
2009~2010学年第二学期第二次月考理科化学试卷
第二卷(非选择题 60分)
19.下列关于乙酸的叙述正确的是
A. 乙酸酸性较弱,不能使紫色石蕊变红
B.乙酸分子中既有极性键,又有非极性键
C.乙酸在常温下能与NaOH、Na2CO3、乙醇等发生化学反应
D.等体积等浓度的盐酸和乙酸中加入足量的锌粒,乙酸产生的氢气质量大
18.乙醇分子中不同的化学键如下图所示,对乙醇在各种反应中应断裂的键说明不正确的是
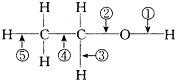 A、和金属钠作用时,键①断裂
B、和浓H2SO4共热至170℃时,键②和⑤断裂
C、和CH2COOH共热时,键②断裂
D、在Ag催化剂下和O2反应时,键①和③断裂
A、和金属钠作用时,键①断裂
B、和浓H2SO4共热至170℃时,键②和⑤断裂
C、和CH2COOH共热时,键②断裂
D、在Ag催化剂下和O2反应时,键①和③断裂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com