
32.(2010山东卷)(8分)[化学-物质结构与性质]
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
解析:(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2P轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×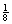 =1个,Ba2+:1个,O2-:12×
=1个,Ba2+:1个,O2-:12×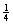 =3个,故化学式为:PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,故每个Ba2+与12个O2-配位
=3个,故化学式为:PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,故每个Ba2+与12个O2-配位
答案:(1) sp2 范德华力
(2) C>H >Si
(3) <
7.(2010天津卷)(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
解析:(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
(2) N和H 1:3构成的分子为NH3,电子式为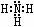 ;2:4构成的分子为N2H4,其结构式为
;2:4构成的分子为N2H4,其结构式为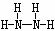 。
。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:2、8 、18、6,故其原子序数为34;其最高价氧化物对应的水化物的化学式类似H2SO4,为H2SeO4。
非金属性越强,与氢气反应放出的热量越多,故2→5周期放出的热量依次是:d、c、b、a,则第四周期的Se对应的是b。
(4)Al作阳极失去电子生成Al3+,Al3++3HCO3-==Al(OH)3+3CO2,2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
答案:
(1)O 第三周第ⅢA族 Al>C>N>O>H
(2) 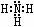
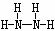
(3) 34 H2SeO4 b
(4) Al-3e-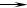 Al3+ Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3
Al3+ Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
命题立意:本题以元素的推断为背景,综合考查了元素符号的书写、元素位置的判断和原子半径大小的比较;考查了电子式、结构式的书写,元素周期律,和电极反应式、化学方程式的书写,是典型的学科内综合试题。
8.(2010四川理综卷)下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成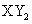 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
答案:B
解析:本题考查物质结构知识;本题可用举例法,氦原子最外层电子数为2,为零族,A项错误;MgCl2中原子序数之差为5,CO2中原子充数之差为2,B项正确;由于HF中存在氢键,故HF的沸点比HCl的高,C项错误;第IA中H2O为分子晶体,其它碱金属氧化物为离子晶体,D项错误。
13.(2010江苏卷)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE古有相同类型的化学键
[答案]BC
[解析]本题主要考查的原子结构与元素周期律的应用。从题目所给条件可以看出A为N元素、B为C元素、C为Na元素、D为Al元素、E为Cl元素,A项,由C、N元素组成的化合物,在常温下,一般形成的原子晶体,呈固态;B项,其对应的最高价氧化物对应的水化物为NaOH和Al(OH)3,能反应;C项,对于Na、Al、Cl2的制备,在工业上都采用电解的方法;D项,化合物AE和NCl3,为分子晶体,只有共价键,化合物CE为NaCl,是离子晶体,存在离子键。综上分析可知,本题选C项。
11.(2010山东卷)下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
解析:离子键是阴阳离子通过静电作用形成的,静电作用包括静电吸引和静电排斥,故A错;因同驻足元素从上到下的非金属性减弱,故HF、HCL、HBr、HI的热稳定性依次减弱,但HF、HCL、HBr、HI的还原性依次增强,故B错;根据元素的非金属性越强,其对应的最高价汉阳算得酸性越强,C错‘因为没有指明是最高价含氧酸;元素周期律的根本原因是元素原子核外电子排布的周期性变化,D正确。
答案:D
20.(2010上海卷)几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
答案:D
答案:此题考查了物质结构与元素周期律知识。根据题给数据,X、Y的化合价不同,但原子半径相差较小,可知两者位于同一周期相邻主族,故金属性X>Y,A错;根据Z、W的原子半径相差不大,化合价不同,且W只有负价,则其可能是O,Z是N,两者的单质直接生成NO,B错;据此判断可知X是Mg,Y是Al;Y的最高价氧化物的水化物是氢氧化铝,其不溶于氨水,C错;一定条件下,氧气可以和氨气反应生成水和氮气,D对。
知识归纳:解答元素推断题的突破口可能是原子结构、元素在周期表中的位置、元素的性质等;在此题中解答时,关键是抓住元素性质和元素在周期表中的位置的关系,从原子半径的变化和元素的最高正价和最低负价入手寻求突破。
8.(2010福建卷)下列有关化学研究的正确说法是
A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、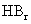 、HI酸性递增的事
、HI酸性递增的事 实,推出F、Cl、Br、I的非金属递增的规律
实,推出F、Cl、Br、I的非金属递增的规律
[解析]答案:B
本题侧重考查反应速率、盖斯定律、分散系、元素周期律重要的基本概念,规律
A. 同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律
B. 这是盖斯定律的表述
C. 分散系的划分是以分散质颗粒大小来区分的
D. 在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的。
10.(2010广东理综卷)短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
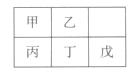 A.原子半径: 丙<丁<戊
B.金属性:甲>丙
A.原子半径: 丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
解析:同周期元素原子半径是减小的,故A错;同主族元素金属性自上而下是增强的,故B错;同周期的元素的金属性越来越弱,故对应碱的碱性也是减弱的,C正确;同周期的最外层电子数越来越多,故D错。
答案:C
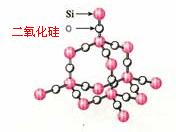
2.(2010全国卷1)13.下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子
[解析]二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角所以A项错误;在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误!
[答案]D
[命题意图]考查学生的空间想象能力,和信息迁移能力,实际上第三册课本第一单元里面有结构图!
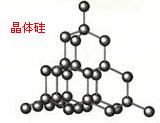
[点评]怎样理解SiO2的结构,可从晶体硅进行转化,晶体硅与金刚石结构相似,只需将C原子换成Si原子即可,课本上有我直接拿来用,再将Si-Si键断开,加入氧即可,见:

但是若将题目中B、B、D三个选项前面分别加上“平均每个”,则本题的答案就又变了,这时就要应用均摊法了,由于每个Si原子被12个环所共用,每个O原子被6个环所共用,每个Si-O键被6个环所共用,则均摊之后在每个环上含有0.5个Si,1个O,2个Si-O键,此时则B、D错误,C正确了,也即在1molSiO2中含有4 mol Si-O键(这是我们经常考的) (2010浙江卷)8. 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B. 由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理中的消毒剂
试题解析:
本题为元素周期律与周期表知识题。首先,运用周期表工具,结合周期规律,考虑位、构、性关系推断X、Y、Z、W、M分别是什么元素。在此基础上应用知识解决题给选项的问题。本题分析的要点或关键词是:短周期元素、同周期、同主族、相同的电子层结构、离子半径大小、单质晶体熔点硬度、半导体材料等。找到突破口:Y单质晶体熔点高硬度大、半导体材料,则Y是Si。根据X、Y、Z、W同周期,Z2- M2-知Z是S,M是O(Z、M同主族)。X+与M2-具有相同的电子层结构则X为Na。离子半径:Z2->W-,则W为Cl。整理一下:X\Y\Z\W\M分别是:Na\Si\S\Cl\O。
A、X、M两种元素能形成X2M和Na2O2两种化合物。B、W、Z、M元素的氢气化物分别为HCl\H2S\H2O,分子量减小,但由于水中存在氢键,沸点最高。C、Y、Z、W的单质分别为:Si\S\O2。分别属于原子晶体和分子晶体两种类型。D、W和M的单质Cl2\O3可作水处理剂。
本题答案:D
教与学提示:
本题考查元素周期表和元素周期律的知识。涉及:单质、化合物、晶体、氢键、物质的性质、用途、结构、原子结构等知识内容。是单一知识内容中的多知识点综合题。考查学生重点知识点的重点掌握情况。要重视双基与能力的培养,重视重点化学知识的突破,重视重点化学工具的学习与应用。元素周期表知识是统帅高中元素化合物知识的重要规律,同时要注意规律下的特例(如化学键与氢键)。元素周期表知识也是高等化学的重要研究手段。
1.(2010全国卷1)下列判断错误的是
A.沸点: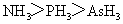 B.熔点:
B.熔点: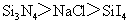
C.酸性: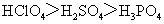 C.碱性:
C.碱性: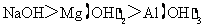
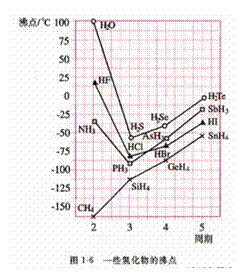 [解析]B考查不同类型晶体的熔沸点高低,2008年高考全国卷I第8题已经考过,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确; C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,2009年高考全国卷I第29题已经考过,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高故应该为:NH3>AsH3>PH3;
[解析]B考查不同类型晶体的熔沸点高低,2008年高考全国卷I第8题已经考过,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确; C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,2009年高考全国卷I第29题已经考过,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高故应该为:NH3>AsH3>PH3;
[答案]A
[命题意图]考查基本概念:如晶体熔沸点高低判断,氢键与范德华力对物质的物性的影响,金属性、非金属性的强弱判断方法具体应用,这些都是平时反复训练的,这道题目实属原题,属于送分题!
[点评]其实还可以拓展:考同种类型晶体的熔沸点高低判断里面的如同为原子晶体或同为离子晶体等,不应该老局限于分子晶体,这样显得2010年高考题与08和09没有太大区别。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com