
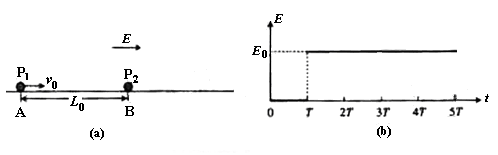
36. (18分)如图(a)所示,在光滑绝缘水平面内存在水平向右的电场,电场强度E随时间的变化如图(b)所示.不带电的绝缘小球P2静止在B点.t = 0时,带正电的小球P1以速度v0从A点开始向右运动,随后与P2发生正碰后反弹,反弹速度大小是碰前速度的一半,P1的质量为m,带电量为q,P2的质量3m,A、B间距为L0.已知
(18分)如图(a)所示,在光滑绝缘水平面内存在水平向右的电场,电场强度E随时间的变化如图(b)所示.不带电的绝缘小球P2静止在B点.t = 0时,带正电的小球P1以速度v0从A点开始向右运动,随后与P2发生正碰后反弹,反弹速度大小是碰前速度的一半,P1的质量为m,带电量为q,P2的质量3m,A、B间距为L0.已知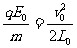 ,
,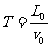 .
.
(1)求第一次碰撞后小球P2的速度.
(2)在两球第一次碰撞后到第二次碰撞前的这段时间内,求两球之间距离的最大值.
广东省汕头市金山中学10届高三上期期末考试
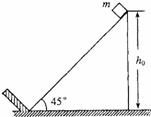
35.(18分)一倾角为θ=45°的斜面固定于地面,斜面顶端离地面的高度h0=1m,斜面底端有一垂直于斜面的固定挡板.在斜面顶端自由释放一质量m=0.9kg的小物块(视为质点).小物块与斜面之间的动摩擦因数μ=0.2.每次小物块与挡板碰撞后都以碰前的速度返回.取重力加速度g=10m/s2.求:
(1)小物块与挡板发生第1次碰撞前瞬间的速度大小.
(2)从一开始到小物块与挡板发生第2次碰撞时,小物 块克服滑动摩擦力做的功.
34.(18分)
(1)小球作直线运动时的频闪照片如图所示.已知频闪周期T=0.1s,小球相邻位置间距(由照片中的刻度尺量得)分别为 OA = 9.76cm,AB = 8.39cm,BC = 7.05 cm,CD = 5.70 cm,DE = 4.34 cm,EF = 3.00 cm.小球在位置 A时速度大小 vA =__________m/s;小球运动的加速度a =__________m/s2.

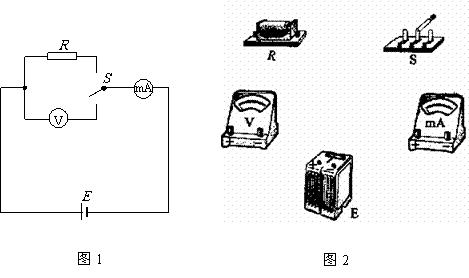
(2)图1中电源电动势为E,内阻可忽略不计;电流表mA具有一定的内阻,电压表V的内阻不是无限大,S为单刀双掷开关,R为待测电阻.当S向电压表一侧闭合时,电压表读数为U1,电流表读数为I1;当S向R一侧闭合时,电流表读数为I2.
①根据已知条件与测量数据,可以得出待测电阻R= .
②根据图1所给出的电路,在图2的各器件实物图之间画出连接的导线.
33.(15分)请你设计实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因 素。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、酒精灯、pH计、pH试纸;lmol/L盐酸、氯化氢气体、1mol/L氢氧化钠、lmol/L氯化铁、蒸馏水。
完成下列探究过程:
(1)写出FeCl3水解的离子方程式:
(2)针对FeCl3水解的影响因素提出假设:
假设 l :溶液的酸碱性 ;
假设 2: ;
假设 3 : 。
(3)基于以上3个假设 , 设计出实验方案,将实验操作、预期的实验现象和结论填在 下表中。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
|
|
|
|
…… |
…… |
…… |
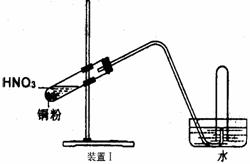
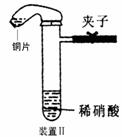
32.(15分)下图是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。(可能用到的相对原子质量: H:1 C:12 N:14 O:16 Cu:64 )
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为 。
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是 ___________________ 。于是他设计装置Ⅱ,其中装铜片的是气球。
(3)化学研究性学习小组的其它同学对上述实验 进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如右:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶。b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球。(整套装置已经过气密性检查合格。)他们做了以下实验,请填写有关空白: ①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是 ②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是: ;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳 ml; ④将上述全过程用一个总的化学方程式表示:
31.(18分)工业合成氨与制备硝酸一般可连续生产,流程如下:
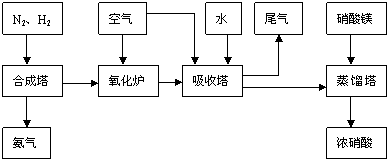

(1)工业生产时,制取氢气的一个反应为:CO+H2O CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)= 。
(2)合成塔中发生反应为:N2(g)+3H2(g)  2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
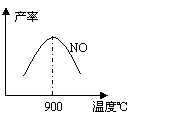 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1
4NO+6H2O △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因 。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:________________________________。
30.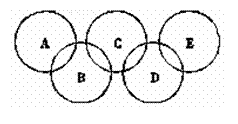 (16分)下图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素。A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3∶4。根据以上信息回答下列问题:
(16分)下图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素。A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3∶4。根据以上信息回答下列问题:
(1)A、B、C、D、E的化学式分别是 。
(2)A燃烧的化学方程式为 。
(3)B的水溶液呈弱酸性,其电离方程式可表示为 ,
(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为
。
29.(14分)科学工作者发现野猪某一个基因与家猪的对应基因的某些片段不同,下表Ⅰ是家猪和野猪的某个基因转录的两种不同的mRNA分子片段(每个密码子只写出前面两个碱基)
表Ⅰ:
|
UA |
UA |
UA |
UA |
UA |
UA |
家猪 |
m RNA |
|
UU |
UU |
UU |
UC |
UC |
UC |
野猪 |
m RNA |
表Ⅱ:密码子表(部分)
|
第一个字母 |
第二个字母 |
第三个字母 |
|||
|
U |
C |
A |
G |
||
|
U |
苯丙氨酸 |
丝氨酸 |
酪氨酸 |
半胱氨酸 |
U |
|
苯丙氨酸 |
丝氨酸 |
酪氨酸 |
半胱氨酸 |
C |
|
|
亮氨酸 |
丝氨酸 |
终止 |
终止 |
A |
|
|
亮氨酸 |
丝氨酸 |
终止 |
色氨酸 |
G |
请根据表Ⅰ、表Ⅱ分析回答下列问题:
(1)由野猪和家猪的该mRNA片段翻译成多肽分子中可能存在氨基酸的种类分别为____ 和 。
(2)比较上表密码子和氨基酸的关系,可以作出哪些推断?
① ;
② ;
③ 。
(3)在决定野猪该信使RNA片段第一个密码子的DNA三个碱基对中,任意一个碱基对发生变化都将产生异常的蛋白质吗?为什么?有何生物学意义?
答: ;理由:
生物学意义: 。
28.(16分)降钙素是一种多肽类激素,临床上用于治疗骨质疏松症等。人的降钙素活性很低,半衰期较短。某科学机构为了研发一种活性高、半衰期长的新型降钙素,从预期新型降钙素的功能出发,推测相应的脱氧核苷酸序列,并人工合成了两条72个碱基的DNA单链,两条链通过18个碱基对形成部分双链DNA片段,再利用Klenow酶补平,获得双链DNA,过程如下图。
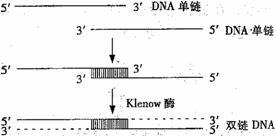
在此过程中发现,合成较长的核苷酸单链易产生缺失碱基的现象。分析回答下列问题:
(1)Klenow酶是一种________酶,合成的双链DNA有________个碱基对。
(2)获得的双链DNA经EcoRⅠ(识别序列和切割位点-G↓AATTC-)和BamHⅠ(识别序列和切割位点-G↓GATCC-)双酶切后插入到大肠杆菌质粒中,筛选含重组质粒的大肠杆菌并进行DNA测序验证。
①大肠杆菌是理想的受体细胞,这是因为它_________________________。
②设计EcoRⅠ和BamHⅠ双酶切的目的是___________________________。
③要进行重组质粒的鉴定和选择,需要大肠杆菌质粒中含有_______________。
(3)经DNA测序表明,最初获得的多个重组质粒,均未发现完全正确的基因序列,最可能的原因是_______________。
(4)上述制备该新型降钙素,运用的现代生物工程技术是____________________。
26.(16分)金鱼是重要的观赏鱼,品种众多,可观赏的性状多种多样。请利用遗传学和生物进化知识回答下列问题。
(1)实验证明,任何品种的金鱼都能与野生鲫鱼杂交,并产生可育后代。这说明金鱼与野生鲫鱼之间不存在 现象。众多金鱼品种的形成是长期的 结果。
(2)研究表明,金鱼的性别由性染色体决定,属于XY型。金鱼培育专家培育的珍贵品种--“蓝剑”,其性染色体组成为XYY。该金鱼所以珍贵,其原因之一是“蓝剑”不能直接产生后代,最根本的原因是 ;“蓝剑”的产生可能是亲本中 个体在减数分裂第 次分裂时遗传物质分配异常所造成的。
(3)基因Aa和Bb是位于非同源染色体上的两对基因。两只金鱼杂交,若子代中不管雌雄个体都表现为A__∶aa=3∶1,B__∶bb=1∶1,则亲本的基因型为 ;若子代中雌鱼全部表现为B控制的性状,雄鱼既有B控制性状又有表现为b控制性状,则亲本的基因型应为 。
(4)若已知金鱼眼睛的性状甲和乙是一对相对性状,并且由位于X染色体上的一对等位基因控制。但实验室只有从自然界捕获的、有繁殖能力的甲性状雌、雄金鱼各一条和乙性状雌、雄金鱼各一条,某同学想通过一次杂交试验确定这对相对性状中的显性性状。他应选择的亲本是 。
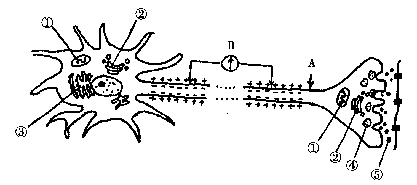 27.(18分)下图为人体神经元细胞模式图,据图回答:
27.(18分)下图为人体神经元细胞模式图,据图回答:
(1)[④] 的形成主要由[ ] (细胞器)完成,⑤的释放方式是 。
(2)此神经元细胞核中有无胰岛素基因? ,理由是 。
(3)若刺激A点,图中电流计将偏转 次。
(4)药物麻醉的原理可能是:抑制 的分泌或抑制
的结合。
(5)若抑制该细胞的呼吸作用,一段时间后,发现神经纤维在一次兴奋后,其细胞膜不能再恢复到外正内负的状态,这说明神经元在恢复到静息状态时,带电离子通过细胞膜的方式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com