
13.(12分)随着纳米材料在生产生活和科学研究中越来越广泛的应用,很多同学对其产生了浓厚的兴趣和探究的欲望。某化学学习小组通过查阅有关资料,按下列步骤自己动手制备纳米铁粉。请结合实验操作回答相关问题。
























 ⑴草酸亚铁晶体(FeC2O4·2H2O)的制备
⑴草酸亚铁晶体(FeC2O4·2H2O)的制备


 ①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、胶头滴管等实验仪器,为配制上述两种溶液,缺少的玻璃仪器为 ,需称量FeSO4·7H2O的质量为 g。
①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、胶头滴管等实验仪器,为配制上述两种溶液,缺少的玻璃仪器为 ,需称量FeSO4·7H2O的质量为 g。
 ②过滤、洗涤过程中,检验草酸亚铁晶体是否洗净的方法是
②过滤、洗涤过程中,检验草酸亚铁晶体是否洗净的方法是
 。
。
 ③分析上述草酸亚铁晶体的制备方案,可推FeC2O4·2H2O具备的性质是 。
③分析上述草酸亚铁晶体的制备方案,可推FeC2O4·2H2O具备的性质是 。
 a.在水中溶解度较小 b.不稳定,受热易分解
a.在水中溶解度较小 b.不稳定,受热易分解
 c.白色固体 d.易被空气氧化
c.白色固体 d.易被空气氧化
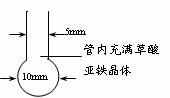
 ⑵纳米铁粉的制备
⑵纳米铁粉的制备
 将一根长度约为12 cm-14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
将一根长度约为12 cm-14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
 ①制备纳米铁粉,反应的化学方程式为
。
①制备纳米铁粉,反应的化学方程式为
。
 ②实验前无需排尽装置中的空气,原因是
。
②实验前无需排尽装置中的空气,原因是
。
12.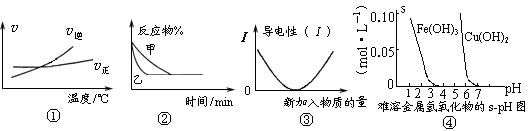 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
第II卷(非选择题 共78分)
11.下列排列顺序完全正确的是 ( )
( )
A.溶解性:NaHCO3>Na2CO3>AgCl>AgI
B.氧化性:MnO2>Cl2>Fe3+>Cu2+
C.常温下,α1、α2、α3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,
则α1=α2>α3
D.同温下,1L0.5mol·L-1NH4Cl溶液中NH4+数与2L0.25mol·L-1NH4Cl溶液中NH4+数分别为a、b,则a>b
10.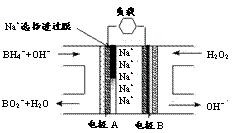 直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是
A.电极B材料中包含MnO2层,MnO2可起催化作用
B.电池负极区的电极反应为:w ww.k s5u. co m
BH +8OH――8e-=BO
+8OH――8e-=BO +6H2O
+6H2O
C.放电过程中,Na+ 从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个
9.下列离子方程式与所述事实相符且正确的是
A.向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B.Na2S溶液吸收足量SO2:S2-+2SO2 +2 H2O =2HSO3- + H2S↑
C.向2 mol·L-1Fe(NO3)2溶液中滴加少量氢碘酸:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
D.向CuSO4溶液中滴加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
8.利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是
|
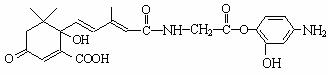
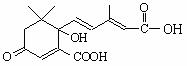

|
A.X结构中有2个手性碳原子
B.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH ,1 molY最多能加成4
molH2
,1 molY最多能加成4
molH2
7.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
|
选项 |
物质 |
试剂 |
分离方法 |
|
A |
铁屑(汽油) |
热纯碱溶液 |
洗涤 |
|
B |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
|
C |
乙醇(水) |
生石灰 |
蒸馏 |
|
D |
苯(苯酚) |
浓溴水 |
分液 |
6.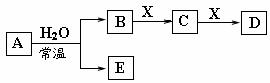
 由短周期元素组成的中学常见无机物A、B、C、D、E、X
由短周期元素组成的中学常见无机物A、B、C、D、E、X 存在如在右图转化关系(部
存在如在右图转化关系(部
分生成物和反应条件略去) 下列推断错误的是
下列推断错误的是
 A.若X是Na2CO3,C为含极性键的非极性分子,
A.若X是Na2CO3,C为含极性键的非极性分子,
则A一定是氯气,且D和E不反应
 B.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E是一种清洁的能源
B.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E是一种清洁的能源
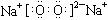
 C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
 D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
5.用NA表示阿伏加德罗常数的值。下列叙述正确的组合是
① 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0 .1NA
② 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
③ 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA。
④ 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
⑤ 100 mL 1 mol·L-1 AlCl3溶液中含阳离子数大于0.1NA
⑥ 含有NA个NO2、N2O4分子的混合气体,降低温度,混合气体的分子总数小于NA
A.①②⑥ B.②④⑥ C.③⑤⑥ D.①⑤⑥
4.在下列溶液中,各组离子一定能够大量共存的是( )
A.含有大量I-的溶液:H+、Fe3+、Cl-、NO3- 
B.加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、HCO3-
C.常温下pH=7的溶液:Fe3+、Na+、Cl-、NO3-
D.常温下c(OH-)/c(H+)=1012的溶液:K+、Ba2+、Cl-、Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com